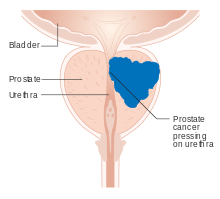
Активное наблюдение за раком простаты - Active surveillance of prostate cancer
Активное наблюдение - это вариант лечения локализованного рака простаты, который может быть предложен соответствующим пациентам, которые также могут быть кандидатами на агрессивные местные методы лечения (хирургическое вмешательство и лучевая терапия), с намерением вмешаться, если болезнь прогрессирует. Активное наблюдение не следует путать с бдительным ожиданием , еще одной стратегией наблюдения для мужчин, которые не могут быть кандидатами на лечебную терапию (хирургическое вмешательство, лучевая терапия) из-за ограниченной продолжительности жизни. Активное наблюдение предлагает мужчинам с раком простаты, который, как считается, имеет низкий риск причинения вреда при отсутствии лечения, шанс отложить или избежать агрессивного лечения и связанных с ним побочных эффектов. В то время как рак простаты является наиболее распространенным некожным раком и Это вторая ведущая причина смерти американских мужчин от рака. По консервативным оценкам, примерно 100 000 мужчин в год в Соединенных Штатах, которые могли бы иметь право на консервативное лечение при активном наблюдении, проходят ненужное лечение. Лечение локализованного рака простаты является спорным вопросом, и мужчины с локализованным заболеванием, диагностированным сегодня, часто проходят лечение со значительными побочными эффектами, которые не улучшают общие результаты для здоровья. В заявлении конференции NIH о состоянии науки 2011 года о «Роль активного наблюдения в ведении мужчин с локализованным раком простаты» указывается на многие оставшиеся без ответа вопросы о стратегиях наблюдения за раком простаты, которые требуют дальнейших исследований и разъяснений. К ним относятся:
- Повышение точности и последовательности патологической диагностики рака простаты.
- Консенсус относительно того, какие мужчины являются наиболее подходящими кандидатами для активного наблюдения
- Оптимальный протокол для активного наблюдения и возможность индивидуализации подхода на основе клинических факторов и факторов пациента
- Оптимальные способы информирования пациентов о возможности активного наблюдения
- Методы, помогающие пациенту принять решение
- Причины принятия или отказа от активного наблюдения в качестве стратегии лечения
- Краткосрочные и долгосрочные результаты активного наблюдения
В заявлении о консенсусе подчеркивается необходимость хорошо спланированных исследований для решения этих вопросов в качестве важного приоритета исследований в области здравоохранения. Тем временем активный надзор за лечением рака простаты низкого риска теперь предлагается все большему количеству пациентов, при этом обычно считается, что рак простаты не причинит мужчине вреда в течение его жизни, если лечение будет отложено или его избегают. Считается, что для этих мужчин наблюдение предлагает более целенаправленный подход к управлению; избежание ненужного лечения и риска связанных с ним побочных эффектов при одновременном обеспечении лечебного вмешательства для тех, у кого наблюдается прогрессирование заболевания.
История рака простаты в эпоху простатоспецифических антигенов
Скрининг рака простаты на основе специфических антигенов простаты привел к более раннему выявлению рака простаты (стадия миграции) и, таким образом, изменил течение заболевания в отсутствие лечения (естественное течение). Выявление заболеваемости и распространенности рака простаты увеличилось с широко распространенным тестированием на простат-специфический антиген, как и продолжительность жизни мужчин со своим заболеванием, по сравнению с эрой до простатоспецифического антигена. Произошедшая миграция стадий с применением лечебного вмешательства на более ранней стадии, несомненно, привела к снижению смертности от рака простаты. Однако вопрос о том, в какой степени это снижение было связано со скринингом на простат-специфический антиген, остается спорным. Кроме того, поскольку рак простаты прогрессирует медленно и чаще всего обнаруживается у пожилых мужчин с конкурирующими рисками смертности, степень, в которой эти изменения в естественной истории привели к пользе и вреду, также является спорной.
История нелеченого рака простаты
Течение рака простаты при отсутствии лечения (естественная история болезни) оценивалось как в обсервационных исследованиях, так и в рандомизированных исследованиях. Большинство данных о результатах у мужчин, которые не получают лечения от рака простаты, поступают от тех, кто был диагностирован в эпоху до скрининга рака простаты, когда болезнь была диагностирована на более поздней стадии.
Наблюдательные исследования
Результаты у мужчин, не получающих лечение от рака простаты, зависят от степени злокачественности (чем выше степень, тем агрессивнее), продолжительности жизни пациента с этим заболеванием и от того, был ли рак обнаружен при скрининге. Рак предстательной железы, обнаруженный с помощью скрининга на уровень ПСА, выявляется на более ранней стадии, и, как правило, прогрессирование без лечения занимает больше времени по сравнению с раком, обнаруженным на основании физических данных (аномальное пальцевое исследование прямой кишки) и / или симптомов. Таким образом, пожилые мужчины с ограниченной продолжительностью жизни, особенно если их обнаруживают в ходе скрининга, могут не прожить достаточно долго, чтобы им навредил рак.
Результаты мужчин с умеренно дифференцированным (5-7 баллов по шкале Глисона) и плохо дифференцированным (8-10 баллов по шкале Глисона) раком, лечившимся без лечения (бдительное ожидание), сравнивали в эпоху скрининга рака простаты (1992–2002) и до рака простаты. эпоха скрининга (до 1992 г.). Уровень смертности от рака простаты в возрасте 10 лет для мужчин в возрасте 65–74 лет с умеренно дифференцированным раком (оценка по шкале Глисона 5-7), диагностированным с помощью скрининга (в эпоху скрининга рака простаты) и периодов до скрининга рака простаты (без скрининга), составлял от 2-6% и от 15-23% соответственно. Для мужчин с низкодифференцированным раком 10-летняя смертность от рака при скрининге рака простаты и в период до ПСА составляла 25–38% и 50–66%, соответственно. В отдельном исследовании мужчин из эпохи предварительного скрининга рака простаты, которым удалось выжидать (56% в возрасте старше 70 лет), прогрессирование до отдаленных метастазов или смерти от рака простаты составило 13,9% и 12,3%, соответственно, по шкале Глисона 6 или ниже, но значительно выше - 18,2 и 22,7%, 30% и 20%, 44,4% и 55,6% для Глисона 3 + 4, 4 + 3 и 8-10, соответственно. Было подсчитано, что 15-летний уровень смертности от рака простаты, обнаруженного посредством скрининга, будет составлять 0–2% для мужчин в возрасте 55–74 лет с оценкой 6 баллов по шкале Глисона или менее при отсутствии лечения. Эти низкосортные виды рака предстательной железы составляют 60-70% всех случаев рака, обнаруживаемых при скрининге на простат-специфический антиген. Таким образом, пул заболеваний, несущих низкий риск смерти от рака без лечения в течение 10-15-летнего периода, велик при скрининге на основе простатспецифического антигена.
Рандомизированные исследования
Контрольная группа (необработанная) рандомизированных исследований, сравнивающих хирургическое вмешательство с бдительным ожиданием, представляет возможность для оценки естественного течения рака простаты. Скандинавское исследование группы рака простаты-4 (SPGS-4) рандомизировало 695 мужчин (средний возраст 65 лет) для наблюдения по сравнению с радикальной простатэктомией ; 5% были диагностированы с помощью скрининга на основе ПСА, у 3 из 4 было пальпируемое заболевание, и средний уровень ПСА составлял 13 нг / мл на момент постановки диагноза. Признавая, что эти мужчины отличаются от тех, кому сегодня поставлен диагноз при скрининге на ПСА, совокупная частота смерти от рака простаты составила 20,7% в нелеченой группе в целом и 11% для мужчин с заболеванием низкого риска (уровень ПСА ниже 10 нг / мл и оценка Глисона ниже). 7) - аналогично совокупной частоте смерти от рака простаты 12,3% в возрасте 30 лет для мужчин с раком 6 баллов по шкале Глисона, леченным консервативно в упомянутом выше шведском обсервационном исследовании.
В исследовании «Вмешательство против рака простаты» (PIVOT) рандомизировано 731 мужчину с диагнозом «локализованный рак простаты» для проведения радикальной простатэктомии или наблюдения (средний возраст 67 лет; средний уровень ПСА 7,8 нг / мл). В группе наблюдения метастазы в кости и смерть от рака простаты произошли в 10,6% и 8,4% соответственно через 12 лет. Смерть от рака простаты наступила у 5,7% и 17,4% мужчин, которым был поставлен диагноз по шкале Глисона ниже 7 и 7 и выше, соответственно; и 6,2% и 12,8% мужчин с уровнем ПСА 10 нг / мл или ниже и выше 10 нг / мл соответственно. Стратифицированные по группам риска D'Amico (см. Таблицу стратификации риска рака простаты справа для объяснения), смерть от рака простаты наступила у 2,7%, 10,8% и 17,5% мужчин с заболеваниями низкого, среднего и высокого риска, соответственно. Признавая, что мужчины в исследовании PIVOT с большей вероятностью были диагностированы в результате тестирования на основе ПСА по сравнению с мужчинами из SPGS-4, которые этого не сделали, интересно, что кумулятивная смертность от рака простаты в SPGS-4 среди мужчин с заболеванием низкого риска (11%) сопоставимо с мужчинами с заболеванием среднего риска (10,8%) в PIVOT. Эти данные предполагают, что результаты для мужчин с заболеванием низкого риска в эпоху до ПСА сопоставимы с результатами для мужчин, которым сегодня поставлен диагноз заболевания среднего риска.
Обоснование немедикаментозного лечения рака простаты
Скрининг и лечение рака простаты на локализованной стадии на основе ПСА могут предотвратить смерть от рака простаты у некоторых мужчин. Однако, если лечебное вмешательство является последствием каждого выявленного рака простаты при скрининге, большая часть мужчин будет проходить ненужное лечение и испытывать функциональное снижение качества жизни из-за побочных эффектов лечения.
Функциональные исходы и качество жизни после лечения локализованного рака простаты
Через 15 лет после лечения (лучевой терапии или хирургического вмешательства) локализованного рака простаты, диагностированного в 1994–1995 годах, снижение функции мочеиспускания, половой жизни и кишечника было обычным явлением. Это функциональное снижение качества жизни происходит в значительно большей степени среди тех, кто проходит лечение от рака простаты, по сравнению с нормальным стареющим населением без диагноза рака простаты, и симптомы дистресса чаще встречаются среди мужчин с раком простаты, которые проходят лечение, по сравнению с тем, кого не лечили. В современном исследовании качества жизни после лечения (лучевой терапии и хирургического вмешательства) локализованного рака простаты авторы сообщили, что значительная часть мужчин не вернулась к исходной функции в области кишечной, половой и мочевыделительной функции; что изменения качества жизни зависят от лечения; и что удовлетворенность пациентов и партнеров результатами лечения была тесно связана с изменениями качества жизни после лечения. Таким образом, лечение рака простаты обычно приводит к изменениям качества жизни, которые затрагивают как пациента, так и его партнера.
Риски чрезмерного лечения рака простаты
Избыточный диагноз - это обнаружение рака, который в противном случае не был бы диагностирован при жизни хозяина, если бы тест на обнаружение (например, ПСА и / или биопсия простаты) не проводился. Лечение мужчин, которые в противном случае не знали бы о своем раке при отсутствии анализа на уровень ПСА и биопсии, перестало лечиться. Избыточное лечение требует затрат для системы здравоохранения и потенциального вреда для пациента (снижение качества жизни), но без пользы. Избыточное лечение наиболее вероятно при обнаружении рака простаты низкой степени злокачественности , особенно у пожилых мужчин. Данные из различных источников предполагают, что в диапазоне ПСА, в котором сегодня многие мужчины проходят биопсию простаты (ПСА 2-4 нг / мл), у 15-25% будет обнаружен рак простаты, а у 80-90% - низкосортный.
Уровень избыточного лечения в США аналогичен уровню избыточного диагноза, поскольку большинство мужчин подвергаются лечебному вмешательству после получения диагноза рака простаты. Сообщается о диапазоне оценок избыточного диагноза от 23% до 42%, основанных на заболеваемости в США. В зависимости от возраста на момент постановки диагноза и характеристик заболевания вероятность того, что при скрининге рак был диагностирован сверх установленного диагноза, может варьироваться от менее 5% до более 75%.
Непредвиденным последствием новой технологии является ее использование среди тех, кто с наименьшей вероятностью получит выгоду. Тревожная тенденция была отмечена у мужчин с недавно диагностированным раком простаты, лечившихся с помощью роботизированной хирургии и новых форм лучевой терапии (IMRT). Исследование, проведенное в 2013 году, показало, что использование передовых технологий лечения возросло среди мужчин в популяции Medicare, которая с наименьшей вероятностью получит пользу от лечения, несмотря на растущую осведомленность о масштабах избыточного лечения при заболеваниях низкого риска. Даже среди пожилых людей уровень лечения рака простаты низкого риска высок; 59%, 36,6% и 15,8% пациентов в возрасте 75 и 79 лет, 80 и 84 лет и старше или равного 85 лет изначально получали лучевую терапию в одном исследовании с использованием данных Medicare. Эти данные подчеркивают важное несоответствие между доказательствами и практикой, учитывая результаты рандомизированных исследований, сравнивающих лечение с отсутствием лечения (см. «Сравнительные результаты хирургического вмешательства и наблюдения за раком простаты» ниже).
Сравнительные результаты операции и наблюдения при раке простаты
В упомянутом ранее исследовании 4 скандинавской группы рака простаты (SPCG-4) радикальная простатэктомия сравнивалась с бдительным ожиданием у мужчин (средний возраст 65 лет) с локализованным раком простаты, диагностированным в эпоху, предшествовавшую скринингу на ПСА. После 15 лет наблюдения у мужчин, подвергшихся хирургическому лечению, были значительно более низкие показатели отдаленных метастатических заболеваний и смерти от рака простаты. Это преимущество хирургического вмешательства было замечено только среди мужчин моложе 65 лет, но не среди тех, кому 65 лет и старше, у которых хирургическое вмешательство не принесло пользы с точки зрения свободы от метастатического заболевания или смерти от рака простаты. Эти данные подчеркивают важный аспект лечения рака простаты; маловероятная вероятность того, что лечение улучшит исходы для здоровья пожилых мужчин с заболеваниями низкого риска (стадия T1c / T2a и уровень ПСА ниже 10 нг / мл и оценка по Глисону 6).
В исследовании «Вмешательство при раке простаты эпохи ПСА и исследование под наблюдением» (PIVOT) радикальная простатэктомия сравнивалась с бдительным ожиданием у 731 мужчины (средний возраст 67 лет) с локализованным раком простаты. К 12 годам у подгруппы мужчин с уровнем ПСА выше 10 нг / мл и у мужчин с заболеванием от среднего до высокого риска смертность от рака простаты после операции снизилась по сравнению с выжиданием.
Результаты SPGS-4 и PIVOT должны использоваться в практике для пожилых людей с заболеваниями низкого риска, особенно с сопутствующими сопутствующими заболеваниями, которые вряд ли выиграют от лечебного вмешательства. Для этих мужчин отсутствие лечения может быть наиболее рациональным начальным лечением, учитывая, что вред (снижение качества жизни), вероятно, перевешивает любую пользу (снижение смертности от рака простаты).
Выявление кандидатов для наблюдения
Рак простаты в большинстве случаев является медленно прогрессирующим заболеванием. Однако раннее локализованное заболевание излечимо, тогда как метастатическое заболевание - нет. Таким образом, среди клиницистов продолжаются дискуссии о том, следует ли начинать лечение на ранней стадии, чтобы предотвратить диссеминированное заболевание, или наблюдать и откладывать лечение до тех пор, пока не появятся признаки прогрессирования. Первый рискует нанести вред из-за чрезмерного лечения вялотекущей болезни; тогда как последний рискует упустить возможность излечения среди тех, кому суждено испытать прогресс. Неудовлетворенная потребность заключается в выявлении относительно небольшой доли мужчин со смертельным фенотипом, у которых смерть можно предотвратить с помощью лечебного вмешательства, избегая при этом лечения большого количества вялотекущих болезней, которые можно выявить с помощью скрининга.
Выбор пациентов для активного наблюдения зависит от показателей пациента и опухоли, а также от личных предпочтений пациента. Возраст, сопутствующие заболевания и предполагаемая продолжительность жизни пациента важно учитывать, учитывая, что рак простаты может быть медленно прогрессирующим заболеванием, которое может не успевать прогрессировать у тех, у кого оставшиеся годы жизни ограничены. В этом отношении инструменты для оценки ожидаемой продолжительности жизни могут быть полезны при принятии решений.
Что касается показателей опухоли, исследования естественной истории ясно демонстрируют, что оценка Глисона является мощным предиктором риска прогрессирования и распространения заболевания. Поэтому очень важно, чтобы диагноз отражал точную оценку. В этом отношении целевые биопсии под контролем МРТ могут быть лучше обычных систематических биопсий под контролем ТРУЗИ; исследование Национального института здравоохранения, сравнивающее два подхода к биопсии, показало, что целевые результаты биопсии привели к повышению показателей ТРУЗИ-биопсии по Глисону в 32% случаев, что могло исключить активное наблюдение за этими пациентами. Кроме того, при принятии активного решения по эпиднадзору необходимо учитывать дополнительную информацию о факторах риска, предоставляемую стадией и уровнем ПСА при постановке диагноза (см. Таблицу выше). Наконец, при принятии решения следует учитывать предпочтение пациента жить с раком или побочные эффекты лечения. Пациенты со схожими характеристиками заболевания, для которых целесообразно и наблюдение, и лечебное вмешательство, могут иметь разные личные предпочтения. Некоторым может показаться разумной готовность принять снижение качества жизни, чтобы избавиться от рака, который имеет минимальные шансы причинить вред в течение десятилетия или более; в то время как другие предпочли бы жить с раком и поддерживать качество своей жизни. Понимание личных предпочтений пациента должно играть большую роль в совместном принятии решений.
Соответствующим кандидатам предлагается активное наблюдение в качестве варианта лечения локализованного рака простаты, которым также могут быть предложены агрессивные местные методы лечения (хирургическое вмешательство и лучевая терапия) с намерением вмешаться, если болезнь прогрессирует. Активное наблюдение не рекомендуется для мужчин с заболеванием высокого риска или мужчин с первичным паттерном Глисона 4 или 5, у которых имеется значительный риск развития системного заболевания на момент постановки диагноза и прогрессирования до метастатического заболевания при отсутствии лечения. Однако следует рассмотреть возможность активного наблюдения за пациентами с раком простаты очень низкого, низкого и среднего риска (см. Таблицу выше) в зависимости от общего состояния здоровья и продолжительности жизни, а также личных предпочтений. Рекомендации Национального центра комплексного онкологического центра рекомендуют активное наблюдение в качестве предпочтительного варианта лечения для мужчин с заболеванием очень низкого риска и ожидаемой продолжительностью жизни менее 20 лет, а также для мужчин с заболеванием низкого риска и ожидаемой продолжительностью жизни менее 10 лет; и вариант для людей с низким риском заболевания и ожидаемой продолжительностью жизни 10 лет и более или заболеванием среднего риска и ожидаемой продолжительностью жизни менее 10 лет.
Определение прогрессирования и триггеров вмешательства при активном наблюдении
Большинство урологов будут контролировать пациента при наблюдении с помощью ПСА и пальцевого ректального исследования не реже двух раз в год и выполнять контрольную биопсию простаты с интервалом 1-2 года. Однако определить прогрессирование заболевания проблематично. Прогресс в программах активного наблюдения был определен на основании кинетики ПСА или превышения заданного порога ПСА, увеличения степени рака или заболевания более высокой степени при биопсии простаты, изменения пальцевого ректального исследования и перехода к лечебному вмешательству. Тем не менее, изменение уровня ПСА и превышение заданного порогового значения может не отражать прогрессирование заболевания. Изменение стадии или результатов пальцевого ректального исследования необычно среди пациентов с заболеванием низкого риска. Переход от наблюдения к лечебному вмешательству может быть вызван личными предпочтениями или тревогой пациента, а не обязательно изменением рака. Степень рака является наиболее сильным признаком, связанным с долгосрочным отсутствием заболевания у нелеченных мужчин, и поэтому обнаружение рака высокой степени (оценка по шкале Глисона выше 6) является наиболее универсально согласованным триггером для вмешательства для мужчин, находящихся под наблюдением. Тем не менее, похоже, что у большинства мужчин, у которых при эпиднадзорной биопсии обнаруживается заболевание высокой степени злокачественности, при диагностической биопсии не обнаруживается прогрессирование рака от низкой до высокой степени злокачественности. Эта неправильная классификация заболевания при постановке диагноза может быть уменьшена в будущем за счет улучшений в визуализации и оценке биопсии ткани, которые выходят за рамки шкалы Глисона.
Будущее активного наблюдения
Улучшение визуализации простаты, открытие биомаркеров и генетическое профилирование рака простаты, скорее всего, изменит подход к лечению мужчин с диагнозом локализованный рак простаты. В настоящее время активное наблюдение используется недостаточно (частично) из-за двойной озабоченности по поводу неправильной классификации рака при биопсии простаты и невозможности биологически определить, какие виды рака имеют агрессивный фенотип. Таким образом, существует как избыточное лечение вялотекущей болезни, так и лечение агрессивной болезни. В будущем вполне вероятно, что мужчины с недавно диагностированным локализованным раком простаты будут проходить оценку простаты с помощью МРТ, прицельной биопсии поражений, считающихся подозрительными, и сигнатур экспрессии генов, которые сосредоточены на профилировании рака на основе молекулярных путей, связанных с агрессивностью. Вместе с биомаркерами сыворотки и мочи эта новая парадигма может улучшить наши текущие системы стратификации, которые в значительной степени зависят от классификации с помощью светового микроскопа. Этот многомерный подход может улучшить возможность выбора наиболее подходящих кандидатов для наблюдения и нашу способность продольно отслеживать конкретные поражения в предстательной железе для доказательства прогрессирования заболевания. Ряд центров активно привлекают мужчин к программам активного наблюдения и опубликовали результаты этой стратегии лечения рака простаты. К ним относятся программа активного наблюдения в урологическом институте Джеймса Бьюкенена Брэди при медицинских учреждениях Джонса Хопкинса , Университете Торонто и UCSF, все из которых были начаты в начале 1990-х годов; мульти-учреждение, Университет Майами, Международное активное наблюдение за исследованием рака простаты (PRIAS), Royal Marsden, Memorial Sloan Kettering.