Масляная кислота - Butyric acid
|
|
|||
|
|||
| Имена | |||
|---|---|---|---|
|
Предпочтительное название IUPAC
Бутановая кислота |
|||
| Другие имена | |||
| Идентификаторы | |||
|
3D модель ( JSmol )
|
|||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard |
100.003.212 |
||
| Номер ЕС | |||
| КЕГГ | |||
| MeSH | Масляная + кислота | ||
|
PubChem CID
|
|||
| Номер RTECS | |||
| UNII | |||
| Номер ООН | 2820 | ||
|
Панель управления CompTox ( EPA )
|
|||
|
|||
|
|||
| Характеристики | |||
|
C 3ЧАС 7COOH |
|||
| Молярная масса | 88,106 г · моль -1 | ||
| Появление | Бесцветная жидкость | ||
| Запах | Неприятный, похожий на запах рвоты или тела | ||
| Плотность | 1,135 г / см 3 (-43 ° C) 0,9528 г / см 3 (25 ° C) |
||
| Температура плавления | -5,1 ° С (22,8 ° F, 268,0 К) | ||
| Точка кипения | 163,75 ° С (326,75 ° F, 436,90 К) | ||
| Сублимы при −35 ° C Δ subl H |
|||
| Смешиваемый | |||
| Растворимость | Смешивается с этанолом , эфиром . Слабо растворим в CCl 4 | ||
| журнал P | 0,79 | ||
| Давление газа | 0,112 кПа (20 ° C) 0,74 кПа (50 ° C) 9,62 кПа (100 ° C) |
||
|
Константа закона Генри ( k H ) |
5,35 · 10 −4 л · атм / моль | ||
| Кислотность (p K a ) | 4.82 | ||
| -55,10 · 10 -6 см 3 / моль | |||
| Теплопроводность | 1,46 · 10 5 Вт / м · К | ||
|
Показатель преломления ( n D )
|
1,398 (20 ° С) | ||
| Вязкость | 1,814 гр Р (15 ° С) 1,426 сП (25 ° С) |
||
| Состав | |||
| Моноклинический (−43 ° C) | |||
| C2 / м | |||
|
a = 8,01 Å, b = 6,82 Å, c = 10,14 Å
α = 90 °, β = 111,45 °, γ = 90 °
|
|||
| 0,93 Д (20 ° С) | |||
| Термохимия | |||
|
Теплоемкость ( C )
|
178,6 Дж / моль · К | ||
|
Стандартная мольная
энтропия ( S |
222,2 Дж / моль · К | ||
|
Std энтальпия
формации (Δ F H ⦵ 298 ) |
−533,9 кДж / моль | ||
|
Стандартная энтальпия
сгорания (Δ c H ⦵ 298 ) |
2183,5 кДж / моль | ||
| Опасности | |||
| Паспорт безопасности | Внешний паспорт безопасности материала | ||
| Пиктограммы GHS |

|
||
| Сигнальное слово GHS | Опасность | ||
| H314 | |||
| P280 , P305 + 351 + 338 , P310 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | От 71 до 72 ° C (от 160 до 162 ° F, от 344 до 345 K) | ||
| 440 ° С (824 ° F, 713 К) | |||
| Пределы взрываемости | 2,2–13,4% | ||
| Смертельная доза или концентрация (LD, LC): | |||
|
LD 50 ( средняя доза )
|
2000 мг / кг (перорально, крыса) | ||
| Родственные соединения | |||
|
Родственные карбоновые кислоты
|
Пропионовая кислота , пентановая кислота | ||
|
Родственные соединения
|
1-бутанол, бутиральдегид, метилбутират |
||
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|||
| Ссылки на инфобоксы | |||
Масляная кислота (от древнегреческого : βούτῡρον , что означает «масло»), также известная под систематическим названием бутановая кислота , представляет собой алкилкарбоновую кислоту с прямой цепью с химической формулой CH 3 CH 2 CH 2 CO 2 H. Это маслянистая , бесцветная жидкость с неприятным запахом . Изомасляная кислота (2-метилпропановая кислота) является изомером . Соли и сложные эфиры масляной кислоты известны как бутираты или бутаноаты . Кислота не встречается в природе, но ее сложные эфиры широко распространены. Это обычное промышленное химическое вещество и важный компонент в кишечнике млекопитающих.
История
Масляная кислота в нечистой форме была впервые обнаружена в 1814 году французским химиком Мишелем Эженом Шеврёлем . К 1818 году он достаточно очистил его, чтобы охарактеризовать его. Однако Шеврёль не опубликовал свои ранние исследования масляной кислоты; вместо этого он передал свои находки в виде рукописи секретарю Академии наук в Париже, Франция. Анри Браконно , французский химик, также исследовал состав масла и публиковал свои открытия, что привело к спорам о приоритете. Еще в 1815 году Шеврёль утверждал, что он обнаружил вещество, ответственное за запах масла. К 1817 году он опубликовал некоторые из своих открытий относительно свойств масляной кислоты и назвал ее. Однако только в 1823 году он подробно описал свойства масляной кислоты. Название масляная кислота происходит от древнегреческого : βούτῡρον , что означает «масло», вещество, в котором она была впервые обнаружена. Латинское название butyrum (или бутурум ) похоже.
Вхождение
Триглицериды масляной кислоты составляют 3–4% масла. Когда масло становится прогорклым, масляная кислота высвобождается из глицерида путем гидролиза . Это одна из подгруппы жирных кислот, называемых короткоцепочечными жирными кислотами . Масляная кислота - это типичная карбоновая кислота, которая реагирует с основаниями и влияет на многие металлы. Он содержится в животных жиров и растительных масел , коровьего молока , грудное молоко , сливочное масло , пармезан сыр , запах тела , рвотой , и как продукт анаэробного брожения ( в том числе и в толстой кишке ). Имеет вкус сливочного масла и неприятный запах . Млекопитающие с хорошими способностями к обнаружению запаха, такие как собаки , могут обнаружить его в концентрации 10 частей на миллиард , тогда как люди могут обнаружить его только в концентрациях выше 10 частей на миллион . В пищевой промышленности он используется в качестве ароматизатора .
В организме человека, масляная кислота является одним из двух основных эндогенных агонистов человеческой гидроксикарбоновой кислоты рецептора 2 (ГКО 2 ), A G I / O -coupled G-белок рецептора .
Масляная кислота присутствует в виде своего октилового эфира в пастернаке ( Pastinaca sativa ) и в семенах дерева гинкго .
Производство
Промышленные
В промышленности масляная кислота производится гидроформилированием из пропена и синтез-газа с образованием масляного альдегида , который окисляется до конечного продукта.
- H 2 + CO + CH 3 CH = CH 2 → CH 3 CH 2 CH 2 CHO → масляная кислота
Его можно отделить от водных растворов путем насыщения солями, такими как хлорид кальция . Кальциевая соль Ca (C 4 H 7 O 2 ) 2 · H 2 O менее растворима в горячей воде, чем в холодной.
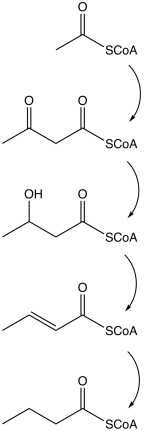
Микробный биосинтез
Бутират производится несколькими процессами ферментации, выполняемыми облигатными анаэробными бактериями . Этот путь ферментации был открыт Луи Пастером в 1861 году. Примеры видов бактерий, продуцирующих бутират :
- Clostridium butyricum
- Clostridium kluyveri
- Clostridium pasteurianum
- Faecalibacterium prausnitzii
- Fusobacterium nucleatum
- Butyrivibrio fibrisolvens
- Eubacterium limosum
Путь начинается с гликолитическим расщеплением глюкозы до двух молекул из пирувата , как это происходит в большинстве организмов. Пируват окисляется до ацетилкофермента А, катализируемого пируватом: ферредоксин оксидоредуктазой . Две молекулы диоксида углерода (CO 2 ) и две молекулы элементарного водорода (H 2 ) образуются как отходы. Впоследствии АТФ производится на последнем этапе ферментации. На каждую молекулу глюкозы вырабатываются три молекулы АТФ, что дает относительно высокий выход. Сбалансированное уравнение для этого брожения:
- С 6 Н 12 О 6 → С 4 Н 8 О 2 + 2 СО 2 + 2 Н 2
Другие пути образования бутирата включают восстановление сукцината и диспропорционирование кротоната.
| Действие | Ответственный фермент |
|---|---|
| Ацетилкофермент А превращается в ацетоацетилкофермент А | ацетил-КоА-ацетилтрансфераза |
| Ацетоацетил-кофермент А превращается в β-гидроксибутирил-КоА. | β-гидроксибутирил-КоА дегидрогеназа |
| β-гидроксибутирил-КоА превращается в кротонил-КоА | кротоназ |
| Кротонил-КоА превращается в бутирил-КоА (CH 3 CH 2 CH 2 C = O-CoA) | бутирил-КоА дегидрогеназа |
| Фосфат группа замещает CoA с образованием бутирили фосфат | фосфобутирилаза |
| Фосфатная группа присоединяется к АДФ с образованием АТФ и бутирата. | бутираткиназа |
Некоторые виды образуют ацетон и н- бутанол альтернативным путем, который начинается с ферментации бутирата. Некоторые из этих видов:
- Clostridium acetobutylicum , самый известный производитель ацетона и бутанола, также используется в промышленности.
- Clostridium beijerinckii
- Clostridium tetanomorphum
- Clostridium aurantibutyricum
Эти бактерии начинают ферментацию бутирата, как описано выше, но, когда pH падает ниже 5, они переключаются на производство бутанола и ацетона, чтобы предотвратить дальнейшее снижение pH. На каждую молекулу ацетона образуется две молекулы бутанола.
Изменение пути происходит после образования ацетоацетил-КоА. Затем это промежуточное звено принимает два возможных пути:
- ацетоацетил-КоА → ацетоацетат → ацетон
- ацетоацетил-КоА → бутирил-КоА → бутиральдегид → бутанол
Источники ферментируемого волокна
Остатки высоко ферментируемых волокон, например, из устойчивого крахмала , овсяных отрубей , пектина и гуара , трансформируются бактериями толстой кишки в короткоцепочечные жирные кислоты (SCFA), включая бутират, производя больше SCFA, чем менее ферментируемые волокна, такие как целлюлозы . Одно исследование показало, что резистентный крахмал постоянно производит больше бутирата, чем другие типы пищевых волокон . Производство SCFA из волокон у жвачных животных, таких как крупный рогатый скот, отвечает за содержание бутирата в молоке и масле.
Фруктаны - еще один источник растворимых пищевых волокон пребиотиков, которые могут перевариваться с образованием бутирата. Они часто встречаются в растворимых волокнах продуктов с высоким содержанием серы , таких как лук и овощи семейства крестоцветных . Источники фруктановы включают пшеницу (хотя некоторые из пшеницы штаммов , такая как пишется содержат меньшие количества), рожь , ячмень , лук , чеснок , Иерусалим и артишок , спаржа , свекла , цикорий , листы одуванчика , лук - порей , радиккио , белая часть зеленого луки , брокколи , брюссельская капуста , капуста , фенхель и пребиотики , такие как фруктоолигосахариды ( ФОС ), олигофруктоза и инулин .
Реакции
Масляная кислота реагирует как типичная карбоновая кислота: она может образовывать амидные , сложноэфирные , ангидридные и хлоридные производные. Последний, бутирилхлорид, обычно используется в качестве промежуточного продукта для получения других.
Использует
Масляная кислота используется для получения различных сложных эфиров бутирата. Он используется для производства бутирата ацетата целлюлозы (CAB), который используется в широком спектре инструментов, красок и покрытий и более устойчив к разрушению, чем ацетат целлюлозы . CAB может разлагаться под воздействием тепла и влаги с выделением масляной кислоты.
Низкомолекулярные эфиры масляной кислоты, такие как метилбутират , в основном имеют приятный аромат или вкус. Как следствие, они используются как пищевые и парфюмерные добавки. Это одобренный пищевой ароматизатор в базе данных EU FLAVIS (номер 08.005).
Из-за сильного запаха он также использовался в качестве добавки к рыболовной наживке. Многие коммерчески доступные ароматизаторы, используемые в приманках для карпа ( Cyprinus carpio ), используют масляную кислоту в качестве сложноэфирной основы. Неясно, привлекает ли рыбу сама масляная кислота или добавленные в нее вещества. Масляная кислота была одной из немногих органических кислот, которые оказались вкусными как для линя, так и для горького . Вещество используется как вонь бомбы по морской пастух общество охраны нарушить японские китобойные экипажей.
Фармакология
| Ингибированный фермент | IC 50 ( нМ ) | Въездная записка |
|---|---|---|
| HDAC1 | 16 000 | |
| HDAC2 | 12 000 | |
| HDAC3 | 9 000 | |
| HDAC4 | 2 000 000 | Нижняя граница |
| HDAC5 | 2 000 000 | Нижняя граница |
| HDAC6 | 2 000 000 | Нижняя граница |
| HDAC7 | 2 000 000 | Нижняя граница |
| HDAC8 | 15 000 | |
| HDAC9 | 2 000 000 | Нижняя граница |
| CA1 | 511 000 | |
| CA2 | 1 032 000 | |
| Цель GPCR | пЭК 50 | Въездная записка |
| FFAR2 | 2,9–4,6 | Полный агонист |
| FFAR3 | 3,8–4,9 | Полный агонист |
| ГКА 2 | 2,8 | Агонист |
Фармакодинамика
Масляная кислота (pK a 4,82) полностью ионизируется при физиологическом pH , поэтому ее анион является материалом, который в основном важен в биологических системах. Это один из двух основных эндогенных агонистов человеческого гидроксикарбоновой кислоты рецептора 2 (ГКА 2 , он же GPR109A), A G I / O -coupled G-белком рецепторов (GPCR) , ,
Подобно другим короткоцепочечным жирным кислотам (SCFA), бутират является агонистом рецепторов свободных жирных кислот FFAR2 и FFAR3 , которые действуют как сенсоры питательных веществ, которые облегчают гомеостатический контроль энергетического баланса ; однако среди группы SCFA только бутират является агонистом HCA 2 . Это также ингибитор HDAC (в частности, HDAC1, HDAC2, HDAC3 и HDAC8), лекарство, которое ингибирует функцию ферментов гистондеацетилазы , тем самым способствуя ацетилированному состоянию гистонов в клетках. Ацетилирование гистонов ослабляет структуру хроматина за счет уменьшения электростатического притяжения между гистонами и ДНК . В целом считается, что факторы транскрипции не могут получить доступ к областям, в которых гистоны тесно связаны с ДНК (т. Е. Неацетилированы, например, гетерохроматин). Следовательно, считается, что масляная кислота усиливает транскрипционную активность промоторов, которые обычно подавляются или подавляются из-за активности гистондеацетилазы.
Фармакокинетика.
Бутират, который вырабатывается в толстой кишке в результате микробной ферментации пищевых волокон, в первую очередь абсорбируется и метаболизируется колоноцитами и печенью для образования АТФ во время энергетического метаболизма; однако некоторое количество бутирата всасывается в дистальном отделе толстой кишки , который не связан с воротной веной, тем самым обеспечивая системное распределение бутирата по системам многих органов через систему кровообращения. Бутират, достигший системного кровообращения, может легко преодолевать гематоэнцефалический барьер через переносчики монокарбоксилатов (т.е. некоторых членов группы переносчиков SLC16A ). Другие переносчики, которые опосредуют прохождение бутирата через липидные мембраны, включают SLC5A8 (SMCT1), SLC27A1 (FATP1) и SLC27A4 (FATP4).
Метаболизм
Масляная кислота метаболизируется различными ХМ-лигазами человека (ACSM1, ACSM2B, ASCM3, ACSM4, ACSM5 и ACSM6), также известными как бутират-КоА-лигаза. Метаболитом, продуцируемым в этой реакции, является бутирил-КоА , который образуется следующим образом:
- Аденозинтрифосфат + масляная кислота + кофермент А → аденозинмонофосфат + пирофосфат + бутирил-КоА
Будучи короткоцепочечной жирной кислотой , бутират метаболизируется митохондриями в качестве источника энергии (например, аденозинтрифосфата или АТФ) посредством метаболизма жирных кислот . В частности, это важный источник энергии для клеток, выстилающих толстую кишку млекопитающих (колоноцитов). Без бутиратов клетки толстой кишки подвергаются аутофагии (т. Е. Самоперевариванию) и погибают.
У людей предшественник бутирата трибутирин , который в природе присутствует в масле, метаболизируется триацилглицерин липазой в дибутирин и бутират в результате реакции:
- Трибутирин + H 2 O → дибутирин + масляная кислота
Биохимия
Бутират оказывает многочисленные эффекты на энергетический гомеостаз и связанные с ним заболевания ( диабет и ожирение ), воспаление и иммунную функцию (например, он оказывает выраженное антимикробное и антиканцерогенное действие) у людей. Эти эффекты проявляются в его метаболизме в митохондриях для выработки АТФ во время метаболизма жирных кислот или через одну или несколько его гистон-модифицирующих ферментов- мишеней (т. Е. Гистоновых деацетилаз класса I ) и мишеней рецепторов, связанных с G-белком (т. Е. FFAR2 , FFAR3 , и ГКА 2 ).
В кишечнике млекопитающих
Бутират необходим для поддержания иммунного гомеостаза организма. Хотя роль и значение бутирата в кишечнике до конца не изучены, многие исследователи утверждают, что истощение запасов бутират-продуцирующих бактерий у пациентов с несколькими васкулитами имеет важное значение для патогенеза этих заболеваний. Истощение бутирата в кишечнике обычно вызвано отсутствием или истощением бактерий, продуцирующих бутират (BPB). Это истощение BPB приводит к микробному дисбактериозу . Это характеризуется общим низким биоразнообразием и истощением основных элементов, производящих бутират. Бутират является важным микробным метаболитом, который играет жизненно важную роль в качестве модулятора правильной иммунной функции хозяина. Было показано, что дети с дефицитом ДГП более подвержены аллергическим заболеваниям и диабету 1 типа. Бутират также снижается при диете с низким содержанием клетчатки, которая может вызывать воспаление и иметь другие неблагоприятные эффекты, поскольку эти короткоцепочечные жирные кислоты активируют PPAR-γ .
Бутират играет ключевую роль в поддержании иммунного гомеостаза как локально (в кишечнике), так и системно (через циркулирующий бутират). Было показано, что он способствует дифференцировке регуляторных Т-клеток . В частности, циркулирующий бутират вызывает образование экстратимических регуляторных Т-клеток. Низкие уровни бутирата у людей могут способствовать снижению опосредованного регуляторными Т-клетками контроля, тем самым способствуя мощному иммунопатологическому Т-клеточному ответу. С другой стороны, кишечный бутират ингибирует местные провоспалительные цитокины. Следовательно, отсутствие или истощение этих BPB в кишечнике может быть возможным помощником в чрезмерно активной воспалительной реакции. Бутират в кишечнике также защищает целостность кишечного эпителиального барьера. Таким образом, снижение уровня бутирата приводит к повреждению или дисфункции кишечного эпителиального барьера.
В исследовании 2013 года, проведенном Furusawa et al., Было обнаружено, что бутират микробного происхождения играет важную роль в индукции дифференцировки регуляторных Т-клеток толстой кишки у мышей. Это имеет большое значение и, возможно, имеет отношение к патогенезу и васкулиту, связанному со многими воспалительными заболеваниями, поскольку регуляторные Т-клетки играют центральную роль в подавлении воспалительных и аллергических реакций. В нескольких исследованиях было продемонстрировано, что бутират индуцирует дифференцировку регуляторных Т-клеток in vitro и in vivo. Противовоспалительная способность бутирата была тщательно проанализирована и подтверждена многими исследованиями. Было обнаружено, что бутират, продуцируемый микроорганизмами, ускоряет производство регуляторных Т-клеток, хотя конкретный механизм, с помощью которого это происходит, неясен. Совсем недавно было показано, что бутират играет важную и прямую роль в модуляции экспрессии генов цитотоксических Т-клеток. Бутират также оказывает противовоспалительное действие на нейтрофилы, уменьшая их миграцию в раны. Этот эффект опосредуется рецептором HCA 1.
Иммуномодуляция и воспаление
Воздействие бутирата на иммунную систему опосредуется посредством ингибирования гистоновых деацетилаз класса I и активации его рецепторов- мишеней, связанных с G-белком : HCA 2 (GPR109A), FFAR2 (GPR43) и FFAR3 (GPR41). Среди короткоцепочечных жирных кислот бутират является наиболее мощным промотором регуляторных Т-клеток кишечника in vitro и единственным из группы, который является лигандом HCA 2 . Было показано, что он является важным медиатором воспалительной реакции толстой кишки. Он обладает как профилактическим, так и терапевтическим потенциалом для противодействия язвенному колиту, опосредованному воспалением, и колоректальному раку .
Бутират обладает антимикробными свойствами у людей, которые опосредуются антимикробным пептидом LL-37 , который он индуцирует посредством ингибирования HDAC гистона H3. В пробирке, бутират увеличивает экспрессию гена из FOXP3 (далее регулятор транскрипции для Tregs ) и способствует ободочной регуляторных Т - клеток (Tregs) через ингибирование класса I гистондезацетилаз ; благодаря этим действиям он увеличивает экспрессию интерлейкина 10 , противовоспалительного цитокина . Бутират также подавляет воспаление толстой кишки, ингибируя пути передачи сигналов IFN-γ - STAT1 , что частично опосредуется ингибированием гистондеацетилазы . В то время как временная передача сигналов IFN-γ обычно связана с нормальным иммунным ответом хозяина , хроническая передача сигналов IFN-γ часто связана с хроническим воспалением. Было показано, что бутират ингибирует активность HDAC1, который связан с промотором гена Fas в Т-клетках, что приводит к гиперацетилированию промотора Fas и усилению регуляции рецептора Fas на поверхности Т-клеток.
Подобно другим изученным агонистам HCA 2 , бутират также оказывает заметное противовоспалительное действие в различных тканях, включая мозг, желудочно-кишечный тракт, кожу и сосудистую ткань . Связывание бутирата в FFAR3 индуцирует высвобождение нейропептида Y и способствует функциональному гомеостазу слизистой оболочки толстой кишки и кишечной иммунной системы.
Рак
Было показано, что бутират является важным медиатором воспалительной реакции толстой кишки. Он отвечает за около 70% энергии колоноцитов, являясь критически важным SCFA в гомеостазе толстой кишки . Бутират обладает как профилактическим, так и терапевтическим потенциалом для противодействия язвенному колиту (ЯК), опосредованному воспалением, и колоректальному раку . Он оказывает различное воздействие на здоровые и раковые клетки: это известно как «парадокс бутирата». В частности, бутират подавляет опухолевые клетки толстой кишки и стимулирует пролиферацию здоровых эпителиальных клеток толстой кишки. Объяснение того, почему бутират является источником энергии для нормальных колоноцитов и индуцирует апоптоз в раковых клетках толстой кишки , заключается в эффекте Варбурга в раковых клетках, который приводит к тому, что бутират не метаболизируется должным образом. Это явление приводит к накоплению бутирата в ядре, действующего как ингибитор гистондеацетилазы (HDAC). Одним из механизмов, лежащих в основе функции бутирата при подавлении воспаления толстой кишки, является ингибирование сигнальных путей IFN-γ / STAT1 . Было показано, что бутират ингибирует активность HDAC1, который связан с промотором гена Fas в Т-клетках , что приводит к гиперацетилированию промотора Fas и усилению регуляции рецептора Fas на поверхности Т-клеток. Таким образом, предполагается, что бутират усиливает апоптоз Т-клеток в ткани толстой кишки и тем самым устраняет источник воспаления (продукцию IFN-γ). Бутират подавляет ангиогенез , инактивируя активность фактора транскрипции Sp1 и подавляя экспрессию гена фактора роста эндотелия сосудов .
Таким образом, производство летучих жирных кислот, таких как бутират, из ферментируемых волокон может способствовать роли пищевых волокон при раке толстой кишки. Короткоцепочечные жирные кислоты , в том числе масляная кислота, вырабатываются полезными бактериями толстой кишки ( пробиотиками ), которые питаются или ферментируют пребиотики, которые представляют собой растительные продукты, содержащие пищевые волокна. Эти короткоцепочечные жирные кислоты приносят пользу колоноцитам, увеличивая выработку энергии, и могут защищать от рака толстой кишки, подавляя пролиферацию клеток.
И наоборот, некоторые исследователи пытались исключить бутират и считать его потенциальным возбудителем рака. Исследования на мышах показывают, что он стимулирует трансформацию эпителиальных клеток толстой кишки с дефицитом MSH2 .
Возможные способы лечения восстановления бутирата
Из-за важности бутирата как регулятора воспаления и фактора, способствующего развитию иммунной системы, истощение запасов бутирата может быть ключевым фактором, влияющим на патогенез многих васкулитов . Таким образом, важно поддерживать здоровый уровень бутирата в кишечнике. Трансплантаты фекальной микробиоты (для восстановления BPB и симбиоза в кишечнике) могут быть эффективны за счет восполнения уровня бутирата. При этом лечении здоровый человек сдает свой стул для трансплантации человеку с дисбактериозом. Менее инвазивным вариантом лечения является введение бутирата в виде пероральных добавок или клизм, которые оказались очень эффективными в купировании симптомов воспаления с минимальными побочными эффектами или их отсутствием. В исследовании, в котором пациентов с язвенным колитом лечили клизмами с бутиратом, воспаление значительно уменьшилось, и кровотечение полностью прекратилось после введения бутирата.
Зависимость
Масляная кислота является ингибитором HDAC , который селективен в отношении HDAC класса I у людей. HDAC представляют собой модифицирующие гистоны ферменты, которые могут вызывать деацетилирование гистонов и подавление экспрессии генов. HDAC являются важными регуляторами синаптического образования, синаптической пластичности и формирования долговременной памяти . Известно, что HDAC класса I участвуют в опосредовании развития зависимости . Масляная кислота и другие ингибиторы HDAC использовались в доклинических исследованиях для оценки транскрипционных, нервных и поведенческих эффектов ингибирования HDAC у животных, зависимых от наркотиков.
Бутиратные соли и сложные эфиры
Бутират или бутановой , ион является С 3 Н 7 С О О - , то сопряженное основание масляной кислоты. Это форма, обнаруженная в биологических системах при физиологическом pH . Масляное или бутановое соединение представляет собой карбоксилатную соль или сложный эфир масляной кислоты.
Примеры
Соли
Сложные эфиры
- Бутилбутират
- Бутирил-КоА
- Бутират ацетата целлюлозы (авиационный допинг)
- Бутират бензоата эстрадиола
- Этилбутират
- Метилбутират
- Пентилбутират
- Трибутирин
Смотрите также
Примечания
использованная литература
Эта статья включает текст из публикации, которая сейчас находится в общественном достоянии : Chisholm, Hugh, ed. (1911). « Масляная кислота ». Британская энциклопедия (11-е изд.). Издательство Кембриджского университета.