Врожденная гиперплазия надпочечников из-за дефицита 21-гидроксилазы - Congenital adrenal hyperplasia due to 21-hydroxylase deficiency
| Врожденная гиперплазия надпочечников из-за дефицита 21-гидроксилазы | |
|---|---|
| Другие имена | 21-ОН CAH |
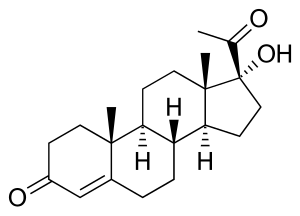 | |
| Дефицит 21-гидроксилазы может привести к накоплению 17α-гидроксипрогестерона. | |
| Специальность |
Эндокринология |
Врожденная гиперплазия надпочечников из-за дефицита 21-гидроксилазы во всех его формах составляет более 95% диагностированных случаев врожденной гиперплазии надпочечников (ВГК), а ВГГ в большинстве случаев относится к дефициту 21-гидроксилазы и различным мутациям, связанным с нарушением ферментов. нанесен на структуру белка.
Презентация
Тяжелая, ранняя форма ХАГ с недостаточностью 21-гидроксилазы
Происходят два наиболее серьезных неонатальных последствия дефицита 21-гидроксилазы : опасные для жизни кризы солевой недостаточности в первый месяц жизни (как для мальчиков, так и для девочек) и тяжелая вирилизация новорожденных девочек. Подразделение раннего начала ХАГ на формы с потерей соли и простой вирилизирующей формой, которое основано на способности надпочечников вырабатывать небольшие количества альдостерона в простой вирилизирующей форме, часто не имеет клинического значения, поскольку клинические проявления частично совпадают и все пациенты в той или иной степени теряют соль.
Кризис из-за излишней соли в младенчестве
Избыточное количество тестостерона надпочечников мало влияет на гениталии младенцев мужского пола с тяжелой формой ХАГ. Если младенец мужского пола с ХАГ не будет обнаружен при скрининге новорожденных , он будет выглядеть здоровым и нормальным, и его быстро выпишут домой к своей семье.
Однако недостаток альдостерона приводит к высокой скорости потери натрия с мочой. Концентрация натрия в моче может превышать 50 мэкв / л. При такой скорости потери соли младенец не может поддерживать объем крови, и к концу первой недели жизни начинает развиваться гипонатремическое обезвоживание . Выведение калия и кислоты также нарушается, когда минералокортикоидная активность недостаточна, и постепенно развиваются гиперкалиемия и метаболический ацидоз . Способность поддерживать кровообращение дополнительно ограничивается эффектом дефицита кортизола. Ранними симптомами являются срыгивание и плохой набор веса, но у большинства младенцев с тяжелой формой ХАГ к второй или третьей неделе жизни развиваются рвота, сильное обезвоживание и циркуляторный коллапс ( шок ).
При доставке в больницу ребенок в возрасте 1-3 недель будет иметь недостаточный вес и обезвоживание по внешнему виду. Артериальное давление может быть низким. Базовый химический анализ покажет гипонатриемию с уровнем Na + в сыворотке, как правило, между 105 и 125 мэкв / л. Гиперкалиемия у этих младенцев может быть очень высокой - уровни K + выше 10 мэкв / л не являются чем-то необычным - как и степень метаболического ацидоза . Может присутствовать гипогликемия . Это называется кризисом солевого истощения, и если его не лечить, быстро наступает смерть.
Какими бы больными ни были эти младенцы, они быстро реагируют на лечение гидрокортизоном и внутривенным солевым раствором, а декстроза быстро восстанавливает объем крови, кровяное давление и содержание натрия в организме и обращает вспять гиперкалиемию. При соответствующем лечении большинство младенцев оказываются вне опасности в течение 24 часов.
Вирилизация младенцев женского пола
Именно фермент 21-гидроксилаза важен для превращения прогестерона и 17α-гидроксипрогестерона в 11-дезоксикортикостерон и 11-дезоксикортизол соответственно. Этот процесс осуществляется путем гидроксилирования в положении C-21. По крайней мере, в 1953 году было описано, что нарушение гидроксилирования стероидов в положении C-21 происходит при врожденной гиперплазии надпочечников и сопровождается чрезмерным количеством 17α-гидроксипрогестерона, что приводит к вирилизму.
При недостаточности 21-гидроксилазы для участия в биосинтезе кортизола 21-гидроксилирование в фасцикулярной зоне коры надпочечников нарушается, поэтому 17α-гидроксипрогестерон и прогестерон не будут должным образом превращаться в 11-дезоксикортизол и 11-дезоксикортикостерон. соответственно - предшественники кортизола и альдостерона. Когда концентрация кортизола и альдостерона в плазме снижается, уровни АКТГ повышаются, что приводит к чрезмерному производству и накоплению предшественников кортизола (особенно 17α-гидроксипрогестерона), которые в конечном итоге передаются андростерону и тестостерону. Другие андрогены могут дополнительно продуцироваться из 17α-гидроксипрогестерона из-за его повышенных уровней, что приводит, среди прочего, к его 5α-восстановлению . Эти дополнительные андрогены производятся так называемым « черным ходом ». Например, в этом «закулисном» пути 5α-дигидротестостерон вырабатывается в обход тестостерона в качестве промежуточного продукта. Некоторые из андрогенов, продуцируемых бэкдорным путем, не могут быть преобразованы в эстрогены с помощью ароматазы , вызывая пренатальную вирилизацию и делая их доминирующими андрогенами при классическом дефиците 21-гидроксилазы.
Вирилизация младенцев генетически женского пола (XX) обычно вызывает очевидную генитальную двусмысленность . Внутри таза яичники в норме, и, поскольку они не подвергались воздействию тестикулярного антимуллерова гормона (АМГ), матка , маточные трубы , верхняя часть влагалища и другие мюллеровы структуры также в норме. Однако высокий уровень тестостерона в крови может увеличивать фаллос , частично или полностью закрывать отверстие влагалища, закрывать уретральную борозду так, что она открывается у основания фаллоса, на стержне или даже на кончике, как у мальчика. Тестостерон может привести к тому, что кожа губ станет такой же тонкой и неровной, как мошонка , но не может производить пальпируемые гонады (т. Е. Яички) в складках.
Таким образом, в зависимости от тяжести гиперандрогении младенец женского пола может быть поражен легким, явно неоднозначным или настолько сильно вирилизованным, что может казаться мужчиной. Андреа Прадер разработала следующую шкалу Прадера как способ описания степени вирилизации.
- Младенец на стадии 1 имеет умеренно большой клитор и немного уменьшенный размер влагалищного отверстия. Эта степень может остаться незамеченной или просто предположить, что она находится в пределах нормы.
- Стадии 2 и 3 представляют все более серьезные степени вирилизации. Гениталии явно ненормальны для глаза, с фаллосом среднего размера и небольшим отверстием во влагалище.
- Этап 4 выглядит более мужчины , чем женщины, с пустой мошонкой и фаллосом размера нормального полового члена, но не вполне свободными достаточно промежности потянуться на живот по направлению к пупку (то есть, что называется искривлением полового члена у мужчин , ). Единственное небольшое отверстие уретры / влагалища в основании или на стержне фаллоса считается гипоспадией у мужчин. Рентген, сделанный после инъекции красителя в это отверстие, показывает внутреннюю связь с верхним отделом влагалища и маткой. Это обычное отверстие может предрасполагать к непроходимости мочевыводящих путей и инфекции .
- Стадия 5 означает полную мужскую вирилизацию с нормально сформированным половым членом с отверстием уретры на кончике или рядом с ним. Мошонка в норме сформирована, но пуста. К внутренним органам малого таза относятся нормальные яичники и матка, а влагалище внутренне соединяется с уретрой, как на стадии 4. Эти младенцы явно не двусмысленны и обычно считаются обычными мальчиками с неопущенными яичками . В большинстве случаев диагноз ХАГ не подозревается до тех пор, пока через неделю не появятся признаки солевой недостаточности.
Когда определение гениталий при рождении неоднозначно, ХАГ является одной из ведущих диагностических возможностей. Оценка показывает наличие матки, чрезмерное повышение 17OHP, уровни тестостерона, приближающиеся или превышающие мужской диапазон, но низкие уровни AMH . Кариотип такой же, как у обычной самки: 46, XX. Имея эту информацию, можно легко поставить диагноз ХАГ и подтвердить женский пол.
Оценка неоднозначных гениталий подробно описана в другом месте . В большинстве случаев подтвердить и назначить женский пол можно в течение 12–36 часов после рождения. Исключением являются редкие, полностью вирилизованные генетические самки (стадия 5 по Прадеру), которые сталкиваются с наиболее сложными задачами и хирургическими дилеммами, обсуждаемыми ниже.
Когда степень неоднозначности очевидна, обычно предлагают и проводят корректирующую операцию. Поскольку реконструктивная хирургия гениталий младенцев стала предметом разногласий, эти вопросы более подробно описаны ниже.
Снижение фертильности
Опухоли покоя яичек надпочечников
Бесплодие, наблюдаемое у взрослых мужчин с врожденной гиперплазией надпочечников (CAH), было связано с опухолями покоя надпочечников яичек (TART), которые могут возникать в детстве. ТАРТ у мужчин препубертатного возраста с классической ХАГ можно было обнаружить в детстве (20%). Мартинес-Агуайо и др. сообщили о различиях в маркерах функции гонад в подгруппе пациентов, особенно в группах с недостаточным контролем.
Женское оплодотворение
У женщин с классическим ХАГ статистически снижена фертильность, особенно у женщин с потерей соли. Уровень живорождения составляет 33–50% при простой вирусной форме ХАГ и 0–10% при наиболее тяжелой форме солевого истощения. При неклассической форме ХАГ живорождение составляет 63% -90%, как и в контрольных группах того же возраста.
Проблемы и споры о назначении пола
Классическая ХАГ приводит к женскому псевдогермафродитизму при рождении и является наиболее частым случаем неопределенности пола, второй - смешанной дисгенезией гонад. Чаще всего при рождении фаллос увеличивается, поэтому он больше, чем у нормальной женщины, но меньше, чем у нормального мужчины. Вместо отдельных отверстий уретры и влагалища имеется урогенитальный синус, который часто покрыт тканью, образовавшейся в результате заднего сращения губно-мошоночных гребней. Таким образом, могут быть обнаружены различные степени аномалий наружных половых органов, от нормальной промежности до уретры полового члена.
Нет никаких трудностей с назначением подходящего пола для большинства младенцев с ХАГ. Генетические самцы имеют нормальные мужские гениталии и гонады и просто нуждаются в заместительной гормональной терапии. Большинство вирилизованных женщин назначаются и воспитываются как девочки, даже если их гениталии неоднозначны или выглядят скорее как мужские, чем женские. У них нормальные яичники и матка и потенциальная фертильность после гормональной заместительной терапии и хирургического вмешательства . Однако дилеммы, связанные с определением пола наиболее сильно вирилизованных младенцев XX, помогли сформировать наше понимание гендерной идентичности и сексуальной ориентации и продолжают оставаться предметом дискуссий.
До 1950-х годов некоторые вирилизованные младенцы XX были назначены и воспитаны как девочки, а некоторые - как мальчики. Наиболее развитая гендерная идентичность соответствует полу их воспитания. В нескольких случаях воспитания самцов смена пола была предпринята в середине детства, когда недавно обнаруженное кариотипирование выявило «женские» хромосомы. Эти переназначения редко были успешными, что привело Джона Мани и других влиятельных психологов и врачей к выводу, что гендерная идентичность (1) не связана с хромосомами, (2) в первую очередь является результатом социального обучения и (3) не может быть легко изменена после младенчества.
К 1960-м годам ХАГ было хорошо изучено, кариотипирование стало обычным делом, а стандартное лечение заключалось в назначении и воспитании всех детей с ХАГ в соответствии с их гонадами и кариотипами, независимо от степени вирилизации. Девочек с выраженной вирилизацией обычно направляли к детскому хирургу , часто к детскому урологу, для реконструктивной вагинопластики и уменьшения или рецессии клитора - операции по созданию или увеличению влагалищного отверстия и уменьшению размера или выпячивания клитора. Этот подход был разработан для сохранения фертильности для обоих полов и остается стандартным лечением, но были поставлены под сомнение два аспекта этого лечения: назначение полностью вирилизованных генетических женщин и ценность и возраст корректирующей операции.
Первые вопросы о назначении были подняты в начале 1980-х, когда Мани и другие сообщили о неожиданно высоком уровне неудач в достижении нормальных половых отношений между взрослыми (например, гетеросексуальной ориентации, брака и детей) у взрослых женщин с ХАГ (хотя у всех был женский пол. личности). Однако выборка была небольшой, и результаты казались интерпретируемыми по-разному: смещение отбора, раннее воздействие гормонов на ориентацию или сексуальная дисфункция, вызванная остаточными аномалиями тела или самой генитальной хирургией. С точки зрения двух десятилетий спустя, отчет стал одним из первых свидетельств того, что стандартная парадигма управления не всегда дает ожидаемые результаты.
Несмотря на эти опасения, существенного противодействия стандартному менеджменту не возникало до середины 1990-х годов, когда совокупность свидетельств и мнений из нескольких источников привела к пересмотру результатов. Несколько интерсекс-групп поддержки и защиты (например, Интерсекс-общество Северной Америки ) начали публично критиковать хирургию младенцев на гениталиях из-за неудовлетворительных результатов некоторых взрослых, оперированных в младенчестве. Их жалобы заключались в том, что у них уменьшилась способность получать удовольствие от половых отношений или что они возмущались тем, что у них не было выбора выбора пола или хирургической реконструкции, оставшейся до тех пор, пока они не стали достаточно взрослыми, чтобы участвовать. ( См. Историю интерсекс-хирургии . )
В 1997 г. во влиятельных статьях Райнера, Даймонда и Сигмундсона предлагалось рассмотреть (1) назначение мужского пола младенцам XX мужского пола (большинство из которых считаются мужскими до тех пор, пока CAH не будет выявлен в возрасте 1-2 недель), и ( 2) отложить реконструктивную операцию до тех пор, пока пациент не станет достаточно взрослым, чтобы участвовать в принятии решения. ( См. « Неоднозначные гениталии» и « Интерсекс» для получения дополнительной информации об этой дискуссии, а также полных цитат. )
Хотя стандартный подход к ведению больных остается «стандартным», во многих случаях больше времени и внимания уделяется объяснению альтернатив родителям, и небольшое количество ХХ детей с явно мужскими внешними гениталиями снова воспитываются как мальчики.
Позднее начало (неклассическое) ХАГ
Андрогенов избыток мягкий достаточно , что вирилизации не является очевидным или проходит незамеченной при рождении и в раннем детстве. Однако уровни андрогенов выше нормы и медленно повышаются в детстве, вызывая заметные эффекты в возрасте от 2 до 9 лет.
Появление лобковых волос в раннем детстве - наиболее частый признак, который требует обследования и диагностики. Другими сопутствующими признаками, вероятно, будут высокий рост и ускоренный костный возраст (часто на 3–5 лет вперед). Часто присутствует увеличение мышечной массы, прыщи и запах тела взрослых . У мальчиков увеличивается пенис . У девочек может наблюдаться умеренное увеличение клитора , а иногда определяется степень пренатальной вирилизации, которая могла остаться незамеченной в младенчестве.
Основные цели лечения неклассического ХАГ - сохранить как можно больше роста и предотвратить центральное преждевременное половое созревание, если оно еще не было вызвано. Это более сложные проблемы, чем при ХАГ, обнаруживаемой в младенчестве, потому что умеренным уровням андрогенов потребуется несколько лет для ускорения созревания костей и запуска центрального полового созревания до того, как болезнь будет обнаружена.
Диагноз неклассического ХАГ обычно подтверждается обнаружением экстремального повышения 17α-гидроксипрогестерона наряду с умеренно высоким уровнем тестостерона. В легких случаях может потребоваться тест на стимуляцию косинтропином , но обычно случайные уровни 17OHP достаточно высоки, чтобы подтвердить диагноз.
Повышенный уровень 17α-гидроксипрогестерона может активировать «черный ход» андрогенов, который приводит к избытку 5α-дигидротестостерона и других сильнодействующих андрогенов при нормальном уровне тестостерона . См. Также: черный ход андрогенов .
Основой лечения является подавление выработки тестостерона надпочечниками с помощью глюкокортикоидов, таких как гидрокортизон . Минералокортикоид добавляют только в тех случаях, когда активность ренина плазмы высока.
Третий ключевой аспект лечения - подавление центрального преждевременного полового созревания, если оно уже началось. Обычные ключи к центральному половому созреванию у мальчиков заключаются в том, что семенники имеют размер пубертата или что тестостерон остается повышенным, даже когда 17OHP снижается до нормального. У девочек центральное половое созревание реже является проблемой, но главным ключом к разгадке может быть развитие груди. Центральное преждевременное половое созревание при необходимости подавляется лейпролидом .
Как указано выше, недавние дополнения к лечению для сохранения роста включают ингибирование ароматазы для замедления созревания костей за счет уменьшения количества тестостерона, превращающегося в эстрадиол , и использование блокаторов эстрогена для той же цели.
Как только подавление надпочечников было достигнуто, пациенту необходимо лечение стрессовыми стероидами, как описано выше, в случае серьезного заболевания или травмы.
Другие аллели приводят к еще более легкой степени гиперандрогении, которая может даже не вызывать проблем у мужчин и может не распознаваться до подросткового возраста или позже у женщин. Легкие эффекты андрогенов у молодых женщин могут включать гирсутизм , угри или ановуляцию (что, в свою очередь, может вызвать бесплодие ). Уровень тестостерона у этих женщин может быть слегка повышенным или просто выше среднего. Эти клинические признаки относятся к синдрому поликистозных яичников (СПКЯ), и при обследовании у небольшого процента женщин с СПКЯ обнаруживается позднее начало ХАГ.
Диагноз ХАГ с поздним началом можно заподозрить на основании высокого уровня 17α-гидроксипрогестерона, но некоторые случаи настолько легкие, что его повышение становится очевидным только после стимуляции косинтропином . Лечение может включать комбинацию глюкокортикоидов в очень низких дозах для снижения выработки андрогенов надпочечниками и любых различных агентов для блокирования эффектов андрогенов и / или индукции овуляции.
Позднее начало ХАГ было первоначально охарактеризовано в 1957 году французским биохимиком Жаком Декуром, но связь с умеренным дефицитом 21-гидроксилазы, называемая неклассическим дефицитом 21-гидроксилазы, который характеризуется разнообразными гиперандрогенными симптомами, появляющимися послеродово у мужчин и женщин, была впервые описана в 1979 году. пользователя Maria New . Новички с тех пор изучили способы уменьшения избытка андрогенов и выяснили, что лечение дексаметазоном 0,25 мг перорально каждый вечер обращает вспять угри и нерегулярные менструации за 3 месяца, но для гирсутизма требуется до 30 месяцев. Дексаметазон обладает глюкокортикоидной активностью и мощными свойствами подавления АКТГ в системе гипоталамус-гипофиз-надпочечники . Более низкий уровень АКТГ приводит к снижению выработки всех стероидов, включая андрогены. Согласно Руководству по клинической практике 2018 года, лечение глюкокортикоидами не рекомендуется у бессимптомных лиц, однако, если симптомы избытка андрогенов достаточны, может быть назначено лечение дексаметазоном. Другой вариант лечения - это оральные противозачаточные таблетки.
Генетика

Ген CYP 21A2 фермента P450c21 (также известный как 21-гидроксилаза ) находится в 6p21.3 среди генов HLA B и HLA DR, кодирующих основные локусы гистосовместимости человека ( HLA ). CYP21A2 спарен с нефункциональным псевдогеном CYP21A1P . Было зарегистрировано множество аномальных аллелей CYP21A2, большинство из которых возникло в результате рекомбинации гомологичных областей CYP21A2 и CYP21A1P . Дефицит 21-гидроксилазы может быть вызван макроделециями размером около 30 т.п.н., которые включают не только большую часть 5'-области гена CYP21A2, но также все гена C4B и 3'-области псевдогена CYP21A1P. Дупликации псевдогена CYP21A1P и гена C4B часто связаны с неклассической недостаточностью 21-гидроксилазы. Из-за высокой степени гомологии между геном CYP21A2 и псевдогеном CYP21A1P, а также сложности локуса исследования на молекулярном уровне затруднены.
Различия в остаточной ферментативной активности различных аллелей определяют различную степень тяжести заболевания. Наследование всех форм 21-гидроксилазы CAH аутосомно-рецессивное .
Люди, пораженные любыми формами заболевания, имеют два аномальных аллеля, и оба родителя обычно являются гетерозиготами (или носителями ). Когда оба родителя несут аномальный аллель, у каждого ребенка есть 25% шанс заболеть этим заболеванием, 50% шанс быть носителем, как и родители, и 25% шанс иметь два нормальных гена.
Теперь можно тестировать на гетерозиготность , измеряя повышение уровня 17α-гидроксипрогестерона после стимуляции АКТГ , или, в последнее время, путем прямого секвенирования генов.
На данный момент идентифицировано более 200 болезнетворных вариантов в гене CYP21A2 , которые приводят к дефициту 21-гидроксилазы, если по крайней мере два из этих вариантов присутствуют как составные гетерозиготные . Между генотипом и фенотипом существует хорошая корреляция. В результате генотипирование CYP21A2 имеет высокую диагностическую ценность. Однако генотипирование гена CYP21A2 подвержено ошибкам, особенно из-за близко расположенного и высокогомологичного псевдогена CYP21A1P и сложных дупликаций, делеций и перестроек в хромосоме 6p21.3. Вот почему генотипирование CYP21A2 , интерпретация результатов и адекватное генетическое консультирование пациентов и их семей требуют глубокого понимания генетики CYP21A2 .
Патофизиология

Фермент P450c21, обычно называемый 21-гидроксилазой (21-OH), встроен в гладкую эндоплазматическую сеть клеток коры надпочечников . Он катализирует гидроксилирование 17α-гидроксипрогестерона (17OHP) до 11-дезоксикортизола по пути глюкокортикоидов , который начинается с прегненолона и заканчивается кортизолом . Он также катализирует гидроксилирование прогестерона до 11-дезоксикортикостерона (ДОК) в минералокортикоидном пути от прегненолона к альдостерону .
Недостаточная активность этого фермента снижает эффективность синтеза кортизола, что приводит к гиперплазии коры надпочечников и повышению уровня АКТГ . АКТГ стимулирует поглощение холестерина и синтез прегненолона. Предшественники стероидов, включая прогестерон, 17α-гидроксипрегненолон и особенно 17α-гидроксипрогестерон, накапливаются в коре надпочечников и в циркулирующей крови. Уровень 17OHP в крови может в 10-1000 раз превышать нормальную концентрацию.
Поскольку активность 21-гидроксилазы не участвует в синтезе андрогенов , значительная часть больших количеств 17α-гидроксипрегненолона уходит на синтез DHEA , андростендиона и тестостерона, начиная с третьего месяца жизни плода у обоих полов.
Синтез альдостерона также зависит от активности 21-гидроксилазы. Хотя плодовитость плода нарушена, это не вызывает пренатальных эффектов, поскольку плацентарное соединение позволяет материнской крови « диализовать » плод и поддерживать как баланс электролитов, так и объем крови.
Диагностика
Поскольку ХАГ является аутосомно-рецессивным заболеванием, большинство детей с ХАГ рождаются от родителей, не подозревающих о риске и не имеющих семейного анамнеза. У каждого ребенка будет 25% шанс родиться с этим заболеванием.
Классификация
Это состояние можно разделить на «солевое истощение», «простую вирилизацию» и «неклассические» формы.
| Тип | Эффекты половых стероидов | Прочие эффекты |
|---|---|---|
| Тяжелая недостаточность 21-гидроксилазы вызывает ХАГ с потерей соли. | Наиболее частая причина неоднозначности гениталий из-за пренатальной вирилизации у генетически женских (XX) младенцев. | Опасная для жизни рвота и обезвоживание, возникающие в течение первых нескольких недель жизни. Уровни альдостерона и кортизола снижаются. |
| Умеренный дефицит 21-гидроксилазы называется простой вирилизирующей ХАГ. | Обычно считается причиной вирилизации у детей препубертатного возраста. | Кортизол снижен, а альдостерон - нет. |
| Еще более легкие формы дефицита 21-гидроксилазы называются неклассическими ХАГ. | Может вызывать андрогенные эффекты и бесплодие у подростков и взрослых женщин. | Ни альдостерон, ни кортизол не снижаются. |
Типы с потерей соли и простой вирилизирующий тип иногда группируются вместе как «классические».
Скрининг новорожденных
Условия, оправдывающие скрининг новорожденных на предмет любого заболевания, включают (1) простой тест с приемлемой чувствительностью и специфичностью , (2) тяжелые последствия, если не диагностирован на ранней стадии, (3) эффективное лечение, если он диагностирован, и (4) частоту в популяции. Достаточно высокий, чтобы оправдать расходы. В последнее десятилетие все больше штатов и стран внедряют скрининг новорожденных на солевое истощение ХАГ из-за дефицита 21-гидроксилазы, который, если не выявлен, приводит к смерти в первый месяц жизни.
Солевое истощение формы ХАГ встречается у 1 из 15 000 рождений и при отсутствии лечения потенциально приводит к летальному исходу в течение месяца. Замена стероидов - простое и эффективное лечение. Однако сам отборочный тест далек от совершенства.
Хотя уровень 17α-гидроксипрогестерона легко измерить и он чувствителен (редко пропускаются реальные случаи), тест имеет более низкую специфичность. Программы скрининга в Соединенных Штатах сообщают, что 99% положительных результатов скрининга оказываются ложноположительными после обследования младенца. Это более высокий уровень ложноположительных результатов, чем скрининговые тесты для многих других врожденных заболеваний обмена веществ .
Измерение 17α-гидроксипрогестерона (17α-OHP) с помощью ЖХ-МС / МС снижает частоту ложноположительных результатов при скрининге новорожденных по сравнению с измерением с помощью иммуноанализов. Предшественники стероидов 17α-ОНР и их сульфатированные конъюгаты, которые присутствуют в первые два дня после рождения у здоровых младенцев и дольше у недоношенных новорожденных, перекрестно реагируют в иммуноанализах с 17α-ОНР, давая ложно высокие уровни 17α-ОНР.
При обнаружении положительного результата младенца необходимо направить к детскому эндокринологу для подтверждения или опровержения диагноза. Поскольку большинство младенцев с солеустойчивым ХАГ становятся критическими к 2-недельному возрасту, оценку необходимо проводить быстро, несмотря на высокий уровень ложноположительных результатов.
Уровни 17α-гидроксипрогестерона , андростендиона и кортизола могут играть роль в скрининге.
Дополнительные маркеры
В то время как 17α-гидроксипрогестерон со стимуляцией АКТГ или без нее является основным маркером дефицита 21-гидроксилазы, были предложены другие маркеры с различной степенью приемлемости:
- Уровень 21-дезоксикортизола повышен при дефиците 21-гидроксилазы. Однако он не повышен у недоношенных детей или при других формах врожденной гиперплазии надпочечников. В отличие от 17α-гидроксипрогестерона , 21-дезоксикортизол не продуцируется в половых железах и происходит исключительно из надпочечников. Следовательно, 21-дезоксикортизол является более специфическим маркером дефицита 21-гидроксилазы, чем 17α-гидроксипрогестерон . Тем не менее, измерение 21-дезоксикортизола обычно не проводилось лабораториями до 2019 года, поэтому с 2020 года опыт ограничен.
- 21-дезоксикортикостерон, также известный как 11β-гидроксипрогестерон (11β-OHP), был предложен в качестве маркера в 1987 году. Исследование, проведенное в 2017 году, показало, что у субъектов с дефицитом 21-гидроксилазы сывороточные концентрации 11β-OHP находятся в диапазоне от 0,012 до 3,37. нг / мл, тогда как в контрольной группе он был ниже предела обнаружения 0,012 нг / мл. Этот маркер не получил признания по состоянию на 2020 год из-за того, что диагностические лаборатории обычно не предлагают тест на уровень этого стероида.
- Уровень прогестерона выше у субъектов с ХАГ. Исследование показало, что сывороточные концентрации прогестерона у мальчиков (от 10 дней до 18 лет) с дефицитом 21-гидроксилазы достигли уровня до 10,14 нг / мл, то есть аналогичны значениям лютеина у женщин, тогда как в контрольной группе средний уровень мальчиков составлял 0,07. нг / мл (0,22 нмоль / л) со значениями от 0,05 до 0,40 нг / мл. Авторы исследования предлагают использовать прогестерон в качестве дополнительного маркера дефицита 21-гидроксилазы. Исследование показывает, что уровни прогестерона у женщин с ХАГ и без ХАГ такие же, как у мужчин с ХАГ и без ХАГ соответственно - это состояние, которое влияет на уровень прогестерона, а не на пол, но для женщин между менархом и менопаузой прогестерон должен быть измеренным в дни 3-5 цикла, чтобы иметь диагностическую ценность - то же самое относится и к 17α-гидроксипрогестерону . Специфичность прогестерона как маркера дефицита 21-гидроксилазы, в отличие от дефицита других ферментов, участвующих в стероидных путях, по состоянию на 2020 год не была хорошо изучена.
- Кортизол является одним из двух основных конечных продуктов 21-гидроксилазы, и дефицит этого фермента может привести к определенной степени дефицита кортизола. Уровень кортизола в среднем ниже у субъектов с ХАГ, однако в более легких случаях уровень кортизола может быть нормальным, но по состоянию на 2020 год это еще недостаточно изучено. Измерение кортизола с помощью иммуноанализов склонно к перекрестной реактивности с различными веществами, включая 21-дезоксикортизол, которая повышается из-за дефицита 21-гидроксилазы, что приводит к ложно высоким уровням кортизола, когда истинный кортизол на самом деле низкий. Селективность, обеспечиваемая жидкостной хроматографией и тандемной масс-спектрометрией (ЖХ-МС / МС), в значительной степени преодолела эти ограничения. В результате использование ЖХ-МС / МС вместо иммуноанализов при измерении кортизола направлено на обеспечение большей специфичности.
- 11-Дезоксикортизол является прямым продуктом 17α-гидроксипрогестерона с 21-гидроксилазой, катализирующей реакцию, и промежуточным продуктом пути кортизола. Снижение активности 21-гидроксилазы приводит к снижению уровней 11-дезоксикортизола, но не все лаборатории указывают его минимальное референсное значение, поскольку он в основном используется в качестве биомаркера дефицита 11β-гидроксилазы , при котором уровни 11-дезоксикортизола резко возрастают, поэтому лаборатории могут укажите только максимальное эталонное значение.
Уход
Дородовое лечение
Начиная с 2018 г., в Руководстве по клинической практике рекомендуется, чтобы врачи продолжали рассматривать пренатальную терапию как экспериментальную.
Поскольку период, в течение которого гениталии плода могут стать вирилизованными, начинается примерно через 6 недель после зачатия, пренатальное лечение во избежание верилизации необходимо начинать через 6-7 недель.
Применение дексаметазона в пренатальном лечении
Надпочечники плодов женского пола с ХАГ начинают вырабатывать избыток андрогенов к 9-й неделе беременности. Наиболее важные аспекты вирилизации (закрытие мочеполовых органов и фаллическая уретра) происходят между 8 и 12 неделями. Теоретически, если бы плод мог получить достаточное количество глюкокортикоидов для снижения выработки тестостерона надпочечниками к 9-й неделе, можно было бы предотвратить вирилизацию и избежать трудного решения о сроках операции .
Проблема предотвращения тяжелой вирилизации девочек имеет двоякую цель: выявление ХАГ в начале беременности и доставка эффективного количества глюкокортикоидов плоду без причинения вреда матери.
Первая проблема еще не решена полностью, но было показано, что если дексаметазон принимает беременная женщина, достаточное количество дексаметазона может проникнуть через плаценту, чтобы подавить функцию надпочечников плода.
В настоящее время нет программных проверок риска в семьях, в которых еще не было ребенка с ХАГ. Для семей, желающих избежать вирилизации второго ребенка, текущая стратегия состоит в том, чтобы начать прием дексаметазона сразу после подтверждения беременности, даже если на этом этапе вероятность того, что беременность будет у девочки с ХАГ, составляет всего 12,5%. Мать принимает дексаметазон каждый день до тех пор, пока не будет безопасно определить, вынашивает ли она больную девочку.
Является ли плод пораженной девочкой, можно определить, взяв образцы ворсинок хориона на 9–11 неделе беременности или с помощью амниоцентеза на 15–18 неделе беременности. В каждом случае пол плода можно определить быстро, и, если плод мужской, прием дексаметазона можно прекратить. Если женщина, плодная ДНК анализируется, чтобы увидеть, несет ли она один из известных аномальных аллелей гена CYP21 . В этом случае дексаметазон продолжают до конца беременности в дозе около 1 мг в день.
Большинство матерей, которые следовали этому плану лечения, испытали, по крайней мере, легкие кушингоидные эффекты глюкокортикоидов, но родили дочерей, гениталии которых гораздо менее вирилизованы.
Дексаметазон используется в качестве не по прямому назначению раннего дородового лечения симптомов CAH в плодов женского пола, но она не лечит , лежащий в основе врожденного расстройства. Шведское клиническое исследование 2007 года показало, что лечение может вызывать когнитивные и поведенческие дефекты, но небольшое количество испытуемых означает, что исследование не может считаться окончательным. Американское исследование 2012 года не обнаружило отрицательных краткосрочных результатов, но обнаружило «более низкую когнитивную обработку у девочек с CAH и женщин с долгосрочным воздействием DEX». Введение внутриутробного дексаметазона было предметом разногласий по вопросам информированного согласия и потому, что лечение должно предшествовать клиническому диагнозу ХАГ у плода женского пола, особенно потому, что внутриутробный дексаметазон может вызывать метаболические проблемы, которые не проявляются до более позднего возраста; Шведские клиники прекратили набор участников для исследований в 2010 году.
Лечение также вызвало обеспокоенность в сообществах ЛГБТ и биоэтики после публикации эссе, размещенного на форуме Центра Гастингса , и исследования в Journal of Bioethical Inquiry, в котором было обнаружено, что для предотвращения появления этих плодов было предложено пренатальное лечение плодов женского пола. от того, чтобы стать лесбиянками после рождения, может сделать их более склонными к "традиционно" женскому поведению и карьере, а также к большему интересу к вынашиванию и воспитанию детей. Ссылаясь на известную попытку мужчины, используя свои знания об эффекте порядка братского рождения, чтобы избежать рождения гомосексуального сына с помощью суррогата , эссеисты (профессор Элис Дрегер из Медицинской школы Файнберга Северо-Западного университета, профессор Эллен Федер из Американского университета и адвокат Энн Tamar-Mattis ) предполагают, что пренатальное лечение «dex» представляет собой первую известную попытку использования внутриутробных протоколов для снижения случаев гомосексуализма и бисексуальности у людей. Исследования по использованию пренатальных гормональных препаратов для предотвращения гомосексуализма восходят к началу 1990-х годов или ранее.
Поскольку CAH является рецессивным геном, и мать, и отец должны быть рецессивными носителями CAH, чтобы ребенок имел CAH. Благодаря достижениям современной медицины, пары с рецессивными генами CAH имеют возможность предотвратить CAH у своих потомков с помощью преимплантационной генетической диагностики (ПГД). При ПГД яйцеклетка оплодотворяется вне тела женщины в чашке Петри (ЭКО). На 3-й день, когда эмбрион превратился из одной клетки в примерно 4-6 клеток, одна из этих клеток удаляется из эмбриона без вреда для эмбриона. Эмбрион продолжает расти до 5-го дня, когда он замораживается или имплантируется матери. Между тем, удаленная клетка анализируется, чтобы определить, есть ли у эмбриона CAH. Если установлено, что у эмбриона есть CAH, родители могут принять решение, хотят ли они имплантировать его матери или нет.
Метаанализ исследований, подтверждающих использование дексаметазона у плодов из группы риска ХАГ, показал, что «менее половины одного процента опубликованных« исследований »этого вмешательства были сочтены достаточно качественными, чтобы предоставить значимые данные для метаанализа. Даже эти четыре исследования были низкого качества ... настолько небрежными, что нарушали профессиональные стандарты медицинской этики "и" не было данных о долгосрочном наблюдении за физическими и метаболическими исходами у детей, подвергшихся воздействию дексаметазона " .
Долгосрочное ведение ХАГ
Ведение младенцев и детей с ХАГ является сложным и требует длительного лечения в детской эндокринной клинике . После подтверждения диагноза и предотвращения или обращения вспять кризиса, связанного с потерей соли, основные проблемы управления включают:
- Начало и мониторинг заместительной гормональной терапии
- Страхование от стресса, предотвращение кризисов, обучение родителей
- Реконструктивная хирургия
- Оптимизация роста
- Оптимизация подавления андрогенов и фертильности у женщин с ХАГ
Замещение гормонов
Основные цели заместительной гормональной терапии - защита от надпочечниковой недостаточности и подавление чрезмерного производства андрогенов надпочечниками .
Глюкокортикоиды назначаются всем детям и взрослым со всеми формами ХАГ, кроме самых легких и поздних. Глюкокортикоиды являются надежной заменой кортизола , снижая тем самым уровень АКТГ . Снижение уровня АКТГ также снижает стимул к продолжающейся гиперплазии и перепроизводству андрогенов. Другими словами, заместительная терапия глюкокортикоидами - это основной метод снижения чрезмерной выработки андрогенов надпочечниками у обоих полов. Ряд глюкокортикоидов доступен для терапевтического использования. Гидрокортизон или жидкий преднизолон предпочтительнее в младенчестве и детстве, а преднизон или дексаметазон часто более удобны для взрослых.
Дозу глюкокортикоидов обычно начинают при минимальном уровне физиологического замещения (6–12 мг / м 2 ), но корректируют в течение всего детства, чтобы предотвратить как подавление роста из-за слишком большого количества глюкокортикоидов, так и ускользание андрогенов из-за слишком малого количества глюкокортикоидов. Уровни 17α-гидроксипрогестерона , тестостерона , андростендиона и других надпочечников в сыворотке крови отслеживаются для получения дополнительной информации, но не могут быть полностью нормализованы даже при оптимальном лечении. ( См. Дополнительную информацию по этой теме в разделе « Глюкокортикоиды» . ) Однако используемые в настоящее время методы терапии глюкокортикоидами могут привести к нефизиологическим дозам, которые, помимо проблем, вызванных чрезмерным воздействием андрогенов, могут нанести вред здоровью. Различные клинические результаты, помимо стероидов, требуют регулярного контроля. Негативные последствия - это в первую очередь результат нефизиологической замены глюкокортикоидов.
Минералокортикоиды заменяются у всех младенцев с солевым истощением и у большинства пациентов с повышенным уровнем ренина . Флюдрокортизон является единственным фармацевтически доступным минералокортикоидом и обычно используется в дозах от 0,05 до 2 мг в день. Уровень электролитов , ренина и артериального давления отслеживается для оптимизации дозы.
Страхование от стресса, предотвращение кризисов, обучение родителей
Даже после постановки диагноза и начала лечения небольшой процент детей и взрослых с ХАГ младенчества или детства умирает от надпочечникового криза. Смертей от этого можно полностью избежать, если ребенок и семья понимают, что ежедневный прием глюкокортикоидов не может прерываться из-за болезни. Когда человек здоров, пропуск дозы или даже нескольких доз может вызвать незначительные немедленные симптомы. Однако потребность в глюкокортикоидах увеличивается во время болезни и стресса, а пропущенные дозы во время болезни, такой как «грипп» (или вирусный гастроэнтерит), могут в течение нескольких часов привести к снижению артериального давления, шоку и смерти.
Чтобы предотвратить это, всех людей, принимающих заместительные глюкокортикоиды, учат увеличивать их дозы в случае болезни, операции, тяжелой травмы или сильного истощения. Что еще более важно, их учат, что рвота требует инъекции гидрокортизона (например, SoluCortef) или другого глюкокортикоида в течение нескольких часов. Эта рекомендация касается как детей, так и взрослых. Поскольку маленькие дети более подвержены рвоте, чем взрослые, детские эндокринологи обычно учат родителей делать инъекции гидрокортизона.
В качестве дополнительной меры предосторожности людям с надпочечниковой недостаточностью рекомендуется носить медицинскую идентификационную бирку или карточку бумажника, чтобы предупредить тех, кто может оказывать неотложную медицинскую помощь, о срочной потребности в глюкокортикоидах.
Реконструктивная хирургия
Никогда не следует рассматривать хирургическое вмешательство для младенцев с генетическим мужским полом (XY), потому что избыток андрогенов не вызывает анатомических аномалий. Тем не менее, хирургическое вмешательство у сильно вирилизованных младенцев ХХ проводится часто и стало предметом дискуссий в последнее десятилетие.
Хирургическая реконструкция аномальных гениталий предлагалась родителям сильно вирилизованных девочек с ХАГ с первой половины 20 века. Цели хирургического вмешательства обычно заключались в сочетании следующего:
- Чтобы внешние гениталии выглядели больше женскими, чем мужскими
- Чтобы эти девочки могли участвовать в нормальных половых контактах, когда они вырастут.
- Чтобы улучшить свои шансы на зачатие
- Для уменьшения частоты инфекций мочевыводящих путей.
В 1950-х и 1960-х годах хирургия часто включала клиторэктомию (удаление большей части клитора), операцию, которая также уменьшала генитальную чувствительность. В 1970-х годах были разработаны новые оперативные методы для сохранения иннервации и функции клитора. Тем не менее, ряд ретроспективных исследований, проведенных за последнее десятилетие, показывают, что (1) сексуальное удовольствие снижается у многих женщин даже после нервосберегающих процедур, и (2) женщины с ХАГ, не перенесшие операции, также имеют значительный уровень сексуальной дисфункции. . ( См. Обзор процедур и возможных осложнений в разделе « Интерсекс-хирургия» , а также в « Истории интерсекс-хирургии» для более полного обсуждения разногласий ). Многие защитники интересов пациентов и хирурги выступают за отсрочку операции до подросткового возраста или позже, в то время как некоторые хирурги продолжают утверждать, что хирургия младенцев имеет преимущества.
Оптимизация роста в CAH
Одним из сложных аспектов долгосрочного лечения является оптимизация роста, чтобы ребенок с ХАГ достиг своего потенциала роста, потому что как недостаточное, так и избыточное лечение могут снизить рост или оставшееся время для роста. Хотя глюкокортикоиды необходимы для здоровья, их дозировка всегда является приблизительной. Даже в умеренно чрезмерных количествах глюкокортикоиды замедляют рост. С другой стороны, андрогены надпочечников легко превращаются в эстрадиол , который ускоряет созревание костей и может привести к раннему закрытию эпифиза . Достижение этой узкой целевой оптимальной дозы затруднено из-за несовершенного воспроизведения нормальных суточных уровней кортизола в плазме, продуцируемых 2 или 3 пероральными дозами гидрокортизона. Как следствие, при традиционном управлении сообщалось о средней потере высоты около 4 дюймов (10 см).
Традиционно детские эндокринологи пытались оптимизировать рост, измеряя ребенка каждые несколько месяцев, чтобы оценить текущую скорость роста, проверяя костный возраст каждые год или два, периодически измеряя уровни 17OHP и тестостерона как индикаторы подавления надпочечников и используя гидрокортизон. для замены глюкокортикоидов, а не преднизона длительного действия или дексаметазона .
Проблема роста еще больше усугубляется при простых вирилизирующих формах ХАГ, которые обнаруживаются при появлении преждевременных лобковых волос в детстве, потому что костный возраст часто наступает на несколько лет раньше в возрасте постановки диагноза. В то время как мальчик (или девочка) с простой вирилизирующей ХАГ выше своих сверстников на тот момент, ему осталось гораздо меньше лет, чтобы вырасти, и он может превратиться из очень высокого 7-летнего ребенка в 62-дюймовую 13-летнюю. -старый, завершивший рост. Даже при подавлении надпочечников у многих из этих детей уже будет центральное преждевременное половое созревание, вызванное длительным воздействием на гипоталамус андрогенов и эстрогенов надпочечников. Если это началось, может быть полезно подавить половое созревание с помощью агониста гонадотропин-рилизинг-гормона, такого как лейпролид, для замедления продолжающегося созревания костей.
В последние годы были исследованы и начали использоваться некоторые новые подходы к оптимизации роста. Можно уменьшить действие андрогенов на организм, блокируя рецепторы антиандрогенами, такими как флутамид, и уменьшая превращение тестостерона в эстрадиол. Это преобразование опосредуется ароматазой и может подавляться блокаторами ароматазы, такими как тестолактон . Блокирование эффектов и превращений эстрогенов позволит использовать более низкие дозы глюкокортикоидов с меньшим риском ускорения созревания костей. Другие предложенные вмешательства включали двустороннюю адреналэктомию для удаления источников андрогенов или лечение гормоном роста для ускорения роста.
Предотвращение гиперандрогении и оптимизация фертильности
По мере завершения роста руководство у девочек с ХАГ меняет акцент на оптимизацию репродуктивной функции. Как избыточный тестостерон из надпочечников, так и чрезмерное лечение глюкокортикоидами могут нарушить овуляцию , что приведет к нарушению менструального цикла или аменорее , а также к бесплодию . Постоянный мониторинг гормонального баланса и тщательная корректировка дозы глюкокортикоидов обычно могут восстановить фертильность, но в целом женщины с ХАГ имеют более низкий коэффициент фертильности, чем сопоставимая популяция.
ХАГ оказывает незначительное влияние на мужскую фертильность, если взрослый не прекращает полностью принимать глюкокортикоидные препараты в течение длительного времени; в этом случае избыточный тестостерон надпочечниками может снизить продукцию яичек, а также сперматогенез.
Психосексуальное развитие и проблемы
Почти все млекопитающие демонстрируют репродуктивное и сексуальное поведение, диморфное по признаку пола (например, лордоз и рост у грызунов ). Многие исследования показали, что пренатальные и ранние постнатальные андрогены играют роль в дифференцировке мозга большинства млекопитающих. Экспериментальные манипуляции уровнями андрогенов внутриутробно или вскоре после рождения могут изменить репродуктивное поведение взрослых.
Девочки и женщины с ХАГ составляют большинство генетических женщин с нормальными внутренними репродуктивными гормонами, которые подвергались воздействию мужского тестостерона на протяжении всей своей дородовой жизни. Более мягкие степени продолжающегося воздействия андрогенов продолжаются в детстве и подростковом возрасте из-за несовершенства текущего лечения ХАГ глюкокортикоидами. Психосексуальное развитие этих девочек и женщин было проанализировано как доказательство роли андрогенов в поло-диморфном поведении человека.
Неоднократно сообщалось, что девочки с ХАГ проводят больше времени с «нетипичными для секса» игрушками и играми с «грубой игрой», чем незатронутые сестры. Эти различия сохраняются и в подростковом возрасте, что выражается в социальном поведении, досуге и карьерных интересах. Интерес к младенцам и становлению матерями по большинству показателей значительно ниже.
Когнитивные эффекты менее очевидны. Измененное внутриутробное и послеродовое воздействие андрогенов, а также терапия глюкокортикоидами влияют на развитие и функции мозга. По сравнению со здоровыми девочками, девочки с классическим ХАГ ведут себя более агрессивно, но обладают лучшими способностями к пространственной навигации, а паттерны активации миндалины различаются у пораженных и здоровых девочек. Терапия глюкокортикоидами при ХАГ ухудшает рабочую память и вызывает изменения мозга, в том числе гиперинтенсивность белого вещества, что предполагает снижение структурной целостности белого вещества.
Однако чаще всего гендерная идентичность девочек и женщин с ХАГ - женская. Сексуальная ориентация более неоднородна, хотя большинство из них гетеросексуалы. В одном исследовании 27% женщин с ХАГ были признаны бисексуальными по своей ориентации.
Опрос в 2020 году 57 женщин с пожизненным опытом ХАГ и 132 родителей женщин с ХАГ в Соединенных Штатах показал, что большинство участников не считают женщин с ХАГ интерсексами и выступают против легального определения женщин с ХАГ интерсексуалами.
Заболеваемость
Согласно большинству исследований, глобальная заболеваемость классическими формами колеблется от примерно 1:14 000 до 1:18 000 рождений, исходя из программ скрининга новорожденных и национальных регистров случаев, но такая ситуация чаще встречается в небольших генетически изолированных популяциях с небольшими генофондами. Распространенность неклассических форм составляет от 1: 200 до 1: 1000 по разным оценкам, а также выше в группах людей с высоким уровнем брака между родственниками, до 1:50.
Смотрите также
- Врожденные нарушения метаболизма стероидов
- Врожденная гиперплазия надпочечников
- Надпочечниковая недостаточность
- Нарушения полового развития
- Интерсексуальность , псевдогермафродитизм и неоднозначные гениталии
- 21-гидроксилаза
использованная литература
внешние ссылки
- GeneReviews / NCBI / NIH / UW запись о врожденной гиперплазии надпочечников с недостаточностью 21-гидроксилазы
- Запись OMIM о врожденной гиперплазии надпочечников с недостаточностью 21-гидроксилазы
| Классификация |
|---|
