Сшивание ДНК - Crosslinking of DNA
В генетике , сшивающие ДНК происходит , когда различные экзогенные или эндогенные агенты реагируют с двумя нуклеотидами в ДНК , образуя ковалентную связь между ними. Эта перекрестная сшивка может происходить внутри одной и той же цепи (внутрицепочечная) или между противоположными цепями двухцепочечной ДНК (межцепочечная). Эти аддукты мешают клеточному метаболизму, например репликации и транскрипции ДНК , вызывая гибель клеток . Однако эти перекрестные связи можно восстановить путем удаления или рекомбинации.
Сшивание ДНК также имеет полезные преимущества в химиотерапии и нацеливании на раковые клетки для апоптоза , а также в понимании того, как белки взаимодействуют с ДНК.
Сшивающие агенты
Многие охарактеризованные сшивающие агенты имеют две независимо реакционноспособные группы в одной и той же молекуле, каждая из которых способна связываться с нуклеотидным остатком ДНК. Эти агенты разделены на основе их источника происхождения и помечены как экзогенные или эндогенные. Экзогенные сшивающие агенты представляют собой химические вещества и соединения, как натуральные, так и синтетические, которые возникают в результате воздействия окружающей среды, такого как фармацевтические препараты, сигаретный дым или автомобильные выхлопные газы. Эндогенные сшивающие агенты представляют собой соединения и метаболиты, которые вводятся клеточными или биохимическими путями внутри клетки или организма.
Экзогенные агенты
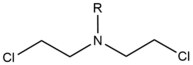
- Азотные иприты представляют собой экзогенные алкилирующие агенты, которые реагируют с положением N 7 гуанина. Эти соединения имеют структуру ядра бис- (2-этилхлор) амина с переменной R -группой, при этом две реакционноспособные функциональные группы служат для алкилирования азотистых оснований и образования сшивки. Эти агенты наиболее предпочтительно образуют межцепочечную сшивку 1,3 5'-d (GNC). Введение этого агента немного изгибает дуплекс ДНК, чтобы приспособиться к присутствию агента внутри спирали. Эти агенты часто вводятся в качестве фармацевтических препаратов и используются в цитотоксической химиотерапии .
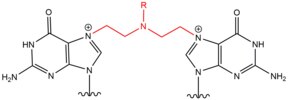
- Цисплатин (цис-диамминдихлорплатина (II)) и его производные в основном действуют на соседние гуанины в их положениях N 7 . Плоское соединение связывается с азотистыми основаниями посредством замещения водой одной или обеих его хлоридных групп, позволяя цисплатину образовывать моноаддукты к ДНК или РНК, внутрицепочечные поперечные связи ДНК, межцепочечные поперечные связи ДНК и поперечные связи ДНК-белок. Когда цисплатин образует поперечные связи ДНК, он чаще образует 1,2-внутрицепочечные поперечные связи (5'-GG), но также образует 1,3-внутрицепочечные поперечные связи (5-GNG) с меньшим процентным содержанием. Когда цисплатин образует межцепочечные перекрестные связи (5'-GC), происходит серьезное искажение спирали ДНК из-за укороченного расстояния между гуанинами на противоположных цепях и цитозином, который выпадает из спирали в результате взаимодействия GG. Подобно азотному иприту, цисплатин часто используется в химиотерапевтическом лечении, особенно при раке яичка и яичников.
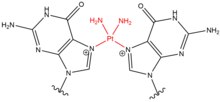
- Хлорэтилнитрозомочевина (CENU), в частности кармустин (BCNU), являются сшивающими агентами, которые широко используются в химиотерапии, особенно при опухолях головного мозга. Эти агенты отличаются от других сшивающих агентов, поскольку они алкилируют O 6 гуанина с образованием O 6 -этаногуанина. Это промежуточное соединение затем приводит к межцепочечной перекрестной связи между парой оснований GC. Эти сшивающие агенты приводят только к небольшим искажениям спирали ДНК из-за меньшего размера молекул.
- Псоралены - это природные соединения (фурокумарины), присутствующие в растениях. Эти соединения интеркалируют в ДНК в сайтах последовательности 5'-AT и образуют тимидиновые аддукты при активации в присутствии ультрафиолетовых лучей A (УФ-A) . Эти ковалентные аддукты образуются путем связывания 3, 4 ( пирон ) или 4 ', 5' ( фуран ) края псоралена с 5, 6 двойной связью тимина . Псоралены могут образовывать два типа моноаддуктов и один диаддукт (межнитевое поперечное сшивание) с тимином . Эти аддукты приводят к локальным искажениям ДНК в месте интеркаляции. Псоралены используются при лечении кожных заболеваний, таких как псориаз и витилиго .
- Митомицин C (MMC) относится к классу антибиотиков, которые широко используются в химиотерапии, часто при раке желудочно-кишечного тракта. Митомицин С может действовать как сшивающий агент, только если нуклеотид ДНК восстановился до своего хинонового кольца. Когда два dG были перегруппированы и метилированы таким образом, 5'-GC межцепочечная сшивка может быть образована с экзоаминами каждого азотистого основания. Митомицин также обладает способностью образовывать моноаддукты и внутрицепочечные сшивки с ДНК. Межцепочечные сшивки Митомицина С образуются в малой бороздке ДНК, вызывая умеренное расширение или растяжение спирали ДНК, чтобы приспособиться к присутствию молекулы внутри двух цепей.
Эндогенные агенты
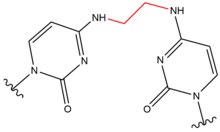
- Азотистая кислота образуется в желудке как побочный продукт из пищевых источников нитритов и может привести к повреждению поперечных сшивок в ДНК за счет преобразования аминогрупп ДНК в карбонилы. Этот тип поражения чаще всего возникает между двумя гуанозинами, причем 1 из 4 дезаминированных гуанозинов приводит к межцепочечному сшиванию. Он индуцирует образование межцепочечных сшивок ДНК в аминогруппе экзоциклического N 2 гуанина в 5'-CG последовательностях. Это поражение слегка искажает двойную спираль.
- Бифункциональные альдегиды представляют собой реактивные химические вещества, которые образуются эндогенно в результате перекисного окисления липидов и биосинтеза простогландинов . Они создают этеноаддукты, образованные альдегидом, которые подвергаются перегруппировке с образованием поперечных связей на противоположных цепях ДНК. Малоновый диальдегид является прототипом, который может сшивать ДНК через две экзоцилциклические аминогруппы гуанина. Другие альдегиды, такие как формальдегид и ацетилальдегид , могут создавать межнитевые поперечные связи и часто действуют как экзогенные агенты, как они присутствуют во многих обработанных пищевых продуктах. Α, β-ненасыщенные альдегиды, такие как акролеин и кротоновый альдегид, которые часто встречаются в пестицидах, табачном дыме и автомобильных выхлопах, являются дополнительными экзогенными агентами, которые могут индуцировать поперечные связи ДНК. В отличие от других сшивающих агентов сшивание, индуцированное альдегидом, по сути является обратимым процессом. Структура ЯМР этих типов агентов в виде межцепочечных сшивок показывает, что аддукт 5'-GC приводит к незначительному искажению ДНК, однако аддукт 5'-CG дестабилизирует спираль и вызывает изгиб и скручивание ДНК.
- Повреждения, связанные с перекрестным связыванием ДНК, также могут образовываться в условиях окислительного стресса, при котором свободные радикалы кислорода генерируют реактивные промежуточные соединения в ДНК, и эти поражения участвуют в старении и раке. Тандемные повреждения ДНК с большой частотой образуются под действием ионизирующего излучения и катализируемых металлами реакций H 2 O 2 . В условиях аноксии преобладающим поражением с двойным основанием является вид, у которого C8 гуанина связан с 5-метильной группой соседнего 3'-тимина (G [8,5-Me] T), образуя внутрицепочечные поражения.
Сводная таблица сшивающих агентов
| Сшивающий агент | Алкилирующий агент | Структура сшивки | Предпочтительная целевая последовательность |
| Азотная горчица | Intrastrand; 5'-GC | ||
| Цисплатин | Intrastrand; 5'-GC
Interstrand; 5'-GNG |
||
| Кармустин (BNCU) | Межстенд; Базовая пара GC | ||
| Митомицин С | Interstrand; 5'-GC | ||
| Псорален | Межстенд; 5'-ТА | ||
| Малоновый диальдегид | Interstrand; 5'-GC, 5'-CG | ||
| Окислительный стресс (и радиация) | Intrastrand; d (ГПТ) | ||
| Азотистая кислота | Interstrand; 5'-CG |
Ремонт сшивок ДНК
Сшитая ДНК репарируется в клетках за счет комбинации ферментов и других факторов пути эксцизионной репарации нуклеотидов (NER), гомологичной рекомбинации и пути эксцизионной репарации оснований (BER). Для восстановления межцепочечных сшивок у эукариот 3'-эндонуклеаза из NER, XPF-ERCC1 , привлекается к сшитой ДНК, где она помогает «расцеплять» ДНК, расщепляя 3'-цепь в месте сшивки. Затем 5'-цепь расщепляется либо XPF-ERCC1, либо другой эндонуклеазой , образуя двухцепочечный разрыв (DSB), который затем может быть восстановлен путем гомологичной рекомбинации .
Сшивки ДНК обычно вызывают потерю информации о перекрывающихся последовательностях двух цепей ДНК. Следовательно, точное восстановление повреждений зависит от восстановления потерянной информации из неповрежденной гомологичной хромосомы в той же клетке. Извлечение может происходить путем спаривания с сестринской хроматидой, полученной во время предыдущего раунда репликации. В диплоидных клетках извлечение также может происходить путем спаривания с несестринской гомологичной хромосомой , что происходит особенно во время мейоза . Как только спаривание произошло, перекрестная сшивка может быть удалена и исправленная информация введена в поврежденную хромосому путем гомологичной рекомбинации.
Расщепление связи между дезоксирибозным сахаром в сахарно-фосфатном остове ДНК и связанным с ним азотистым основанием оставляет основной сайт в двухцепочечной ДНК. Эти базовые участки часто образуются как промежуточные, а затем восстанавливаются при эксцизионной репарации основания. Однако, если этим сайтам позволить сохраняться, они могут ингибировать репликацию и транскрипцию ДНК. Абазовые сайты могут реагировать с аминогруппами на белках с образованием перекрестных связей ДНК-белок или с экзоциклическими аминами других азотистых оснований с образованием межцепочечных перекрестных связей. Чтобы предотвратить межцепочечные или ДНК-белковые сшивки, ферменты пути BER плотно связывают абазический сайт и изолируют его от близлежащих реактивных групп, как показано на примере человеческой алкиладенин-ДНК-гликозилазы (AAG) и 3-метиладенин-ДНК-гликозилазы II (AlkA) E. coli. . Доказательства in vitro продемонстрировали, что межстандартные перекрестные связи, индуцированные абазическим сайтом (DOB-ICL), являются поражением, блокирующим репликацию и сильно ошибочно кодирующим. По сравнению с несколькими другими исследованными TLS pols, pol η, вероятно, вносит вклад в TLS-опосредованную репарацию DOB-ICL in vivo . Используя O 6 -2'-дезоксигуанозин-бутилен-O 6 -2'-дезоксигуанозин (O6-dG-C4-O6-dG) повреждения ДНК, которые представляют собой химически стабильную структуру, было исследовано обходное действие нескольких ДНК-полимераз и результаты показали, что pol η проявляет наивысшую шунтирующую активность; однако 70% обходных продуктов были мутагенными, содержащими замены или делеции. Увеличение размера незакрепленных промежуточных продуктов репарации увеличивает частоту делеционных мутаций.
Лечение кишечной палочки с псорален -plus-УФ - свет ( ПУВА ) производит interstrand сшивок в ДНК клеток. Cole et al. и Sinden и Cole представили доказательства того, что процесс гомологичной рекомбинационной репарации, требующий продуктов генов uvrA , uvrB и recA, может удалить эти перекрестные связи в E. coli . Этот процесс кажется достаточно эффективным. Даже несмотря на то, что одной или двух нерепарированных поперечных связей достаточно для инактивации клетки, бактериальная клетка дикого типа может восстанавливать и, следовательно, восстанавливать от 53 до 71 поперечных связей псоралена. Клетки эукариотических дрожжей также инактивируются одной остающейся перекрестной связью, но дрожжевые клетки дикого типа могут восстанавливать от 120 до 200 перекрестных связей.
Приложения
Сшивание ДНК и белка
Методы биохимического взаимодействия
Сшивание ДНК с белками может быть вызвано множеством химических и физических агентов, включая переходные металлы, ионизирующее излучение и эндогенные альдегиды, в дополнение к химиотерапевтическим агентам . Подобно перекрестному связыванию ДНК, перекрестные связи ДНК-белок представляют собой повреждения в клетках, которые часто повреждаются УФ-излучением. Эффект ультрафиолета может привести к реактивным взаимодействиям и вызвать сшивание ДНК и белков, которые с ней контактируют. Эти поперечные сшивки представляют собой очень объемные и сложные поражения. В основном они возникают в тех областях хромосом, которые подвергаются репликации ДНК и мешают клеточным процессам.
Прогресс в методах идентификации структуры прогрессирует, и добавление возможности измерять взаимодействия между ДНК и белком является требованием для полного понимания биохимических процессов. Структуру комплексов ДНК-белок можно картировать с помощью фотошивки , которая представляет собой фотоиндуцированное образование ковалентной связи между двумя макромолекулами или между двумя различными частями одной макромолекулы. Методология включает ковалентное связывание ДНК-связывающего участка ДНК-связывающего белка, специфичного к целевой последовательности, с фотоактивируемым сшивающим агентом, способным реагировать с нуклеотидами ДНК при воздействии УФ. Этот метод предоставляет информацию о взаимодействии между ДНК и белком в поперечной сшивке.
Клинические методы лечения
Пути репарации ДНК могут привести к образованию опухолевых клеток . Были разработаны методы лечения рака с использованием сшивающих агентов ДНК, которые взаимодействуют с азотистыми основаниями ДНК и блокируют репликацию ДНК. Эти сшивающие агенты обладают способностью действовать как одноэлементные терапевтические средства, нацеливая и разрушая определенные нуклеотиды в раковых клетках. Этот результат останавливает цикл и рост раковых клеток; поскольку он подавляет специфические пути репарации ДНК, этот подход имеет потенциальное преимущество в виде меньшего количества побочных эффектов.
У людей основной причиной смерти от рака во всем мире является рак легких, включая немелкоклеточный рак легкого (НМРЛ), на который приходится 85% всех случаев рака легких в Соединенных Штатах. Людей с НМРЛ часто лечат терапевтическими соединениями платины (например, цисплатином, карбоплатином или оксалиплатином) (см. Химиотерапия рака легких ), которые вызывают межцепочечные сшивки ДНК. Среди людей с NSLC низкая экспрессия гена рака груди 1 ( BRCA1 ) в первичной опухоли коррелировала с улучшением выживаемости после химиотерапии, содержащей платину. Эта корреляция подразумевает, что низкий уровень BRCA1 в раке и, как следствие, низкий уровень репарации ДНК, вызывают уязвимость рака для лечения с помощью сшивающих агентов ДНК. Высокий уровень BRCA1 может защищать раковые клетки, действуя в рамках гомологичного пути рекомбинационной репарации, который устраняет повреждения ДНК, вызванные препаратами платины. Уровень экспрессии BRCA1 потенциально является важным инструментом для настройки химиотерапии при лечении рака легких.
Клинические химиотерапевтические препараты могут вызывать ферментативные и неферментативные перекрестные связи ДНК-белок. Примером такой индукции являются производные платины, такие как цисплатин и оксалиплатин. Они создают неферментативные перекрестные связи ДНК-белок за счет неспецифического перекрестного сшивания белков, взаимодействующих с хроматином, с ДНК. Сшивание также возможно в других терапевтических средствах либо путем стабилизации промежуточных продуктов ковалентной ДНК-белковой реакции, либо путем создания псевдосубстрата, который захватывает фермент на ДНК. Производные камптотецина, такие как иринотекан и топотекан, нацелены на специфическую ДНК- топоизомеразу 1 (TOP1) и улавливают ее путем интеркаляции на границе раздела фермент-ДНК. Поскольку токсичность этих препаратов зависит от улавливания TOP1, клеточная чувствительность к этим соединениям напрямую зависит от уровней экспрессии TOP1. В результате функция этих препаратов заключается в том, чтобы служить в качестве ферментных ядов, а не ингибиторов. Это может быть применено для лечения опухолевых клеток с использованием ферментных ядов TOP 2.
использованная литература
внешние ссылки
- PDB : 1AIO - Интерактивная структура для образования аддукта цисплатина и ДНК
- PDB : 204D - Интерактивная структура для псоралена и сшитой ДНК
- Псорален ультрафиолетовый свет