Эйкозаноид - Eicosanoid
Эйкозаноидам являются сигнальными молекулами , сделанные ферментативного или неферментативного окисления из арахидоновой кислоты или других полиненасыщенных жирных кислот (ПНЖК), которые, подобные арахидоновой кислоты, 20 углеродных единиц в длину. Эйкозаноиды представляют собой подкатегорию оксилипинов , то есть окисленных жирных кислот с различной длиной углеродных единиц, и отличаются от других оксилипинов своей огромной важностью в качестве сигнальных молекул клетки . Эйкозаноиды действуют в различных физиологических системах и патологических процессах, таких как: усиление или подавление воспаления , аллергии , лихорадки и других иммунных реакций ; регулирование прерывания беременности и нормальных родов ; способствуя восприятию боли ; регулирование роста клеток ; контроль артериального давления ; и модулирование регионального кровотока к тканям. Выполняя эти роли, эйкозаноиды чаще всего действуют как аутокринные сигнальные агенты, чтобы воздействовать на свои исходные клетки, или как паракринные сигнальные агенты, воздействующие на клетки, находящиеся поблизости от их исходных клеток. Эйкозаноиды также могут действовать как эндокринные агенты, контролируя функцию отдаленных клеток.
Есть несколько подсемейств эйкозаноидов, в том числе наиболее важное место в простагландины , тромбоксаны , лейкотриены , липоксины , resolvins и eoxins . Для каждого подсемейства существует возможность иметь по крайней мере 4 отдельных ряда метаболитов, два ряда производных от ω-6 ПНЖК (арахидоновая и дигомо-гамма-линоленовая кислоты), один ряд производных от ω-3 ПНЖК (эйкозапентаеновая кислота) и одна серия, полученная из ω-9 ПНЖК (медовая кислота). Это подсемейное различие важно. Млекопитающие, включая человека, неспособны преобразовывать ω-6 в ω-3 ПНЖК. Как следствие, тканевые уровни ω-6 и ω-3 ПНЖК и их соответствующих эйкозаноидных метаболитов напрямую связаны с количеством потребляемых с пищей ω-6 по сравнению с потребляемыми ω-3 ПНЖК. Поскольку некоторые метаболиты из ряда ω-6 и ω-3 ПНЖК обладают почти диаметрально противоположной физиологической и патологической активностью, часто предполагалось, что пагубные последствия, связанные с потреблением рациона, богатого ω-6 ПНЖК, отражают чрезмерное производство и активность. эйкозаноидов, производных ω-6 ПНЖК, в то время как положительные эффекты, связанные с потреблением рациона, богатого ω-3 ПНЖК, отражают чрезмерное производство и активность эйкозаноидов, производных ω-3 ПНЖК. С этой точки зрения, противоположные эффекты эйкозаноидов на основе ω-6 и ω-3 ПНЖК на ключевые клетки-мишени лежат в основе пагубного и положительного воздействия диет, богатых ω-6 и ω-3 ПНЖК, на воспаление и аллергические реакции. атеросклероз , гипертония , рост рака и множество других процессов.
Номенклатура
Источники жирных кислот
«Эйкозаноид» ( eicosa- , греч. «Двадцать»; см. Икосаэдр ) - собирательный термин для линейных полиненасыщенных жирных кислот (ПНЖК) длиной 20 углеродных единиц, которые метаболизируются или иным образом превращаются в кислородсодержащие продукты. К предшественникам ПНЖК эйкозаноидов относятся:
- Арахидоновая кислота ( AA ), то есть 5 Z , 8 Z , 11 Z , 14 Z -эйкозатетраеновая кислота представляет собой ω-6 жирную кислоту с четырьмя двойными связями в цис-конфигурации (см. Цис-транс-изомерию ), каждая из которых расположена между атомами углерода 5- 6, 8-9, 11-12 и 14-15.
- Адреновая кислота ( AdA ), 7,10,13,16-докозатетраеновая кислота, представляет собой ω-6 жирную кислоту с четырьмя двойными цис-связями, каждая из которых расположена между атомами углерода 7-8, 10-11, 13-14 и 17-18. .
- Эйкозапентаеновая кислота ( EPA ), то есть 5 Z , 8 Z , 11 Z , 14 Z , 17 Z -эйкозапентаеновая кислота представляет собой ω-3 жирную кислоту с пятью цис-двойными связями, каждая из которых расположена между атомами углерода 5-6, 8-9, 11. -12, 14-15 и 17-18.
- Дигомо-гамма-линоленовая кислота ( DGLA ), 8 Z , 11 Z , 14 Z -эйкозатриеновая кислота представляет собой ω-6 жирную кислоту с тремя двойными цис-связями, каждая из которых расположена между атомами углерода 8-9, 11-12 и 14-15. .
- Медовая кислота , то есть 5 Z , 8 Z , 11 Z -эйкозатриеновая кислота, представляет собой ω-9 жирную кислоту, содержащую три двойные цис-связи, каждая из которых расположена между атомами углерода 5-6, 8-9 и 11-12.
Сокращенное название
Конкретный эйкозаноид обозначается четырехзначным сокращением, состоящим из:
- его двухбуквенное сокращение ( LT , EX или PG , как описано выше),
- одна буква последовательности ABC,
- Подстрочный индекс или номер простого шрифта, следующий за тривиальным именем обозначенного эйкозаноида, указывает количество его двойных связей . Примеры:
- Простаноиды, полученные из EPA, имеют три двойные связи (например, PGG 3 или PGG3), тогда как лейкотриены, полученные из EPA, имеют пять двойных связей (например, LTB 5 или LTB5).
- Простаноиды, производные от АК, имеют две двойные связи (например, PGG 2 или PGG2), тогда как их лейкотриены, производные от АК, имеют четыре двойные связи (например, LTB 4 или LTB4).
- Гидроперокси-, гидроксил- и оксо-эйкозаноиды содержат заместители гидроперокси (-OOH), гидрокси (-OH) или атома кислорода (= O), связанные с углеродом PUFA одинарной (-) или двойной (=) связью. Их тривиальные названия обозначают заместитель как: Hp или HP для гидроперокси-остатка (например, 5-гидропероокси-эйкозатраеновая кислота или 5- Hp ETE или 5- HP ETE); H для гидроксильного остатка (например, 5-гидрокси-эйкозатетраеновая кислота или 5- H ETE); и оксо- для оксо-остатка (например, 5-оксо-эйкозатетраениовая кислота или 5- оксо- ЕТЕ или 5- оксо- ЕТЕ). Число их двойных границ обозначено их полных и тривиальных названий: AA производных гидроксильные метаболиты имеют четыре (т.е. «тетра» или «Т») двойные связи (например , 5-гидрокси-эйкоза тетра еновой кислоты или 5-ОН Т Е ; ЕРА-производные гидрокси метаболиты имеют пять ( «пента» или «P») двойные связи (например , 5-гидрокси-эйкоз пент еновой кислота или 5-ОН Р Е) и ДГЛК-производные гидроксильные метаболиты имеют три ( «три» или «Тг») двойные связи (например , 5-гидрокси-эйкоз три еновой кислота или 5-ОН Тр Е).
Стереохимия из эйкозаноидов продуктов , образующихся может отличаться среди путей. Для простагландинов это часто обозначается греческими буквами (например, PGF 2α по сравнению с PGF 2β ). Для гидроперокси и гидроксиэйкозаноидов S или R обозначают хиральность их заместителей (например, 5 S -гидрокси-эйкозатетераеновая кислота [также называемая 5 ( S ) -, 5S-гидрокси- и 5 (S) -гидрокси-эйкозатетраеновая кислота] учитывая тривиальные названия 5 S -HETE, 5 ( S ) -HETE, 5S-HETE или 5 (S) -HETE). Поскольку ферменты, образующие эйкозаноид, обычно производят продукты изомеров S либо с явным предпочтением, либо исключительно, использование обозначений S / R часто не используется (например, 5 S -HETE - это 5-HETE). Тем не менее, некоторые пути образования эйкозаноидов действительно образуют R-изомеры, и их S- изомерные продукты по сравнению с R- изомерами могут проявлять совершенно разные биологические активности. Отсутствие указания изомеров S / R может ввести в заблуждение. Здесь все гидроперокси и гидроксизаместители имеют S- конфигурацию, если не указано иное.
Классические эйкозаноиды
Текущее использование ограничивает термин эйкозаноид до:
- Эйкозаноиды серии ω-6, полученные из арахидоновой кислоты:
-
Гидроксиэйкозатетраеновые кислоты ( HETE ) включают следующие метаболиты арахидоновой кислоты:
- 5-HETE , 12-HETE , 15-гидроксиэйкозатетраеновая кислота (т.е. 15-HETE), 20-гидроксиэйкозатетраеновая кислота (т.е. 20-HETE) и 19-HETE (см. 20-гидроксиэйкозатетраеновая кислота ).
- Лейкотриены ( LT ) включают следующие метаболиты арахидоновой кислоты:
- Эоксины ( EX ) включают следующие метаболиты арахидноевой кислоты:
-
Простаноиды, состоящие из нескольких разных типов:
-
Простагландины ( PG ) включают следующие метаболиты арахидоновой кислоты:
- PGG2 , PGH2 , PGE2 , PGD2 , PGF2alpha , PGA2, PGB2 (см. Простаноиды и специализированные про-разрешающие медиаторы # Простагландины и изопростаны ).
-
Простациклины включают:
- PGI2 (см простациклин ).
- Тромбоксаны ( ТХ ) включают следующие метаболиты ацидоновой кислоты:
-
Простагландины циклопентенона включают следующие метаболиты арахидоновой кислоты:
- PGA1, PGA2 (см ' простаноидов , PGJ2, & Dgr ; 12-PGJ2 и 15-дезокси-Δ12,14-PGJ2.
-
Простагландины ( PG ) включают следующие метаболиты арахидоновой кислоты:
-
Гидроксиэйкозатетраеновые кислоты ( HETE ) включают следующие метаболиты арахидоновой кислоты:
- Эйкозаноиды серии ω-6, полученные из дигомо-гамма-линоленовой кислоты. Эти метаболиты являются аналогами эйкозаноидов, производных арахидоновой кислоты, но лишены двойной связи между атомами углерода 5 и 6 и, следовательно, имеют на 1 двойную связь меньше, чем их аналоги, производные арахидоновой кислоты. Они следующие:
- PGA1, PGE1 и TXA1.
- Эйкозаноиды серии ω-3:
-
Resolvins серии E ( RvE ) (resolvins серии D (РВД являются метаболитами 22-углерод ω-3 жирных кислот докозагексаеновой кислоты , см Специализированного про-решения медиаторов # DHA , полученные Resolvins ) RvE включают в себя следующие метаболиты эйкозапентаеновой кислоты. :
- RvE1, 18S-RvE1, RvE2 и RvE3.
- Другие эйкозаноиды, производные эйкозапентаеновой кислоты серии ω-3, являются аналогами метаболитов, производных ω-6 жирных кислот, но содержат двойную связь между углеродом 17 и 18 и, следовательно, имеют на одну двойную связь больше, чем их аналоги на основе арахидоновой кислоты. К ним относятся (HEPE - гидрокси-эйксапентаеновая кислота):
- 5-HEPE (см. Арахидонат-5-липоксигеназа # Eicosapentaenoic acid ), 12-HEPE, 15-HEPE и 20-HETE; LTA5, LTB5 (см. Взаимодействие основных жирных кислот # противодействие ), LTC5, LTD5 и LTE5 (см. Арахидонат-5-липоксигеназа # Эйкозапентаеновая кислота ); PGE3, PGD3, PGF3α и Δ (17) -6-кето PGF1α; PGI3 (см. Взаимодействие с основными жирными кислотами # Противодействие ); и TXA3 и TXB3 (см. номенклатуру взаимодействия основных жирных кислот ).
-
Resolvins серии E ( RvE ) (resolvins серии D (РВД являются метаболитами 22-углерод ω-3 жирных кислот докозагексаеновой кислоты , см Специализированного про-решения медиаторов # DHA , полученные Resolvins ) RvE включают в себя следующие метаболиты эйкозапентаеновой кислоты. :
- Эйкозаноиды серии ω-9
- Гидрокси являются производными от медовой кислоты, метаболизируются до содержащего 3 двойные связи аналога 5-HETE, а именно 5-HETrE (см. Арахидонат- 5-липоксигеназа # Mead acid ).
Гидроксиэйкозатетраеновые кислоты, лейкотриены, эоксины и простаноиды иногда называют «классическими эйкозаноидами».
Неклассические эйкозаноиды
В отличие от классических эйкозаноидов, несколько других классов метаболитов ПНЖК были названы «новыми», «эйкозаноидоподобными» или « неклассическими эйкозаноидами ». К ним относятся следующие классы:
-
Оксоэйкозаноиды ( оксо-ETE ) включают следующие метаболиты:
- 5-оксо-эйкозатетраеновая кислота (5-оксо-ETE), 12-оксо-ETE (см. 12-HETE # Дальнейший метаболизм ) и 15-оксо-ETE, которые являются метаболитами арахидоновой кислоты (см. 15-гидроксиэйкозатетраеновая кислота ) и 5-оксо-ETrE, который является метаболитом медовой кислоты (см. Арахидонат-5-липоксигеназа # Медовая кислота ).
-
Гепоксилины ( Hx ) включают следующие метаболиты арахидоновой кислоты:
- HxA3 и HxB3 (см. Гепоксилины ).
-
Липоксины ( Lx ) включают следующие метаболиты арахидоновой кислоты:
- LxA4 и LxB4 (см. Специализированные про-разрешающие медиаторы ).
-
Эпи-липоксины ( эпи-Lx ) включают следующие метаболиты арахидоновой кислоты:
- 15-epi-LxA4 (также обозначаемый как AT-LxA4) и 15-epi-LxB4 (также обозначаемый как AT-LxB4) (см. Специализированные про-разрешающие медиаторы ).
-
Эпоксиэйкозатриеновые кислоты ( EET ) включают следующие метаболиты арахидоновой кислоты:
- 5,6-EET, 8,9-EET, 11,12-EET и 14,15-EET (см. Эпоксиэйкозатриеновая кислота ).
-
Эпоксиэйкозатетраеновая кислота ( EEQ ) включает следующие метаболиты эйкозапентаеновой кислоты:
- 5,6-EEQ, 8,9-EEQ, 11,12-EEQ, 14,15-EEQ и 15,16-EEQ (см. Эпоксиэйкозатетраеновая кислота ).
-
Изопростаны ( isoP ) представляют собой неферментативные производные полиненасыщенных жирных кислот, которые изучаются как маркеры окислительного стресса ; они включают следующие изоР, производные арахидоновой кислоты, названные на основе их структурного сходства с PG:
- D2-isoPs, E2-isoPs, A2-isoPs и J2-isoPs; и два эпоксидсодержащих isoP, 5,6-эпоксиизопростан E2 и 5,6-эпоксиизопростан A2. Было показано, что некоторые из этих isoP обладают противовоспалительной активностью (см. Специализированные про-разрешающие медиаторы # Простагландины и изопростаны ).
- Изофураны представляют собой неферментативно образованные производные полиненасыщенных жирных кислот, которые обладают фурановой кольцевой структурой; они изучаются как маркеры окислительного стресса. Существует 256 потенциально различных изомеров, содержащих фурановое кольцо, которые могут быть производными арахидоновой кислоты.
- Эндоканнабиноиды - это определенные глицеролипиды или дофамин, которые этерифицированы до полиненасыщенных жирных кислот, которые активируют каннабиноидные рецепторы . Они включают следующие агенты, этерифицированные арахидоновой кислотой:
Метаболизм эйкозапентаеновой кислоты в HEPE, лейкотриены, простаноиды и эпоксиэйкозатетраеновые кислоты, а также метаболизм дигомо-гамма-линоленовой кислоты до простаноидов и медовой кислоты до 5 (S) -гидрокси-6E, 8Z, 11-Z-эйкозовой кислоты HETrE), 5-оксо-6,8,11-эйкозатриеновая кислота (5-оксо-ETrE), LTA3 и LTC3 задействуют те же ферментативные пути, что и их аналоги на основе арахидоновой кислоты.
Биосинтез
Эйкозаноиды обычно не хранятся в клетках, а синтезируются по мере необходимости. Они происходят из жирных кислот , составляющих клеточную мембрану и ядерную мембрану . Эти жирные кислоты должны высвобождаться из своих мембран, а затем сначала метаболизироваться до продуктов, которые чаще всего далее метаболизируются различными путями с образованием большого количества продуктов, которые мы распознаем как биоактивные эйкозаноиды.
Мобилизация жирных кислот
Биосинтез эйкозаноидов начинается, когда клетка активируется механической травмой, ишемией , другими физическими нарушениями, атакой патогенов или стимулами, создаваемыми соседними клетками, тканями или патогенами, такими как хемотаксические факторы , цитокины , факторы роста и даже некоторые эйкозаноиды. Затем активированные клетки мобилизуют ферменты, называемые фосфолипазой A 2 (PLA 2 s), способные высвобождать ω-6 и ω-3 жирные кислоты из мембранных накопителей. Эти жирные кислоты связаны сложноэфирной связью с положением SN2 мембранных фосфолипидов ; PLA 2 действуют как эстеразы, высвобождая жирную кислоту. Существует несколько классов PLA 2 s, причем цитозольные PLA 2 типа IV (cPLA 2 s), по-видимому, ответственны за высвобождение жирных кислот во многих условиях активации клеток. CPLA 2 действуют специфически на фосфолипиды, которые содержат AA, EPA или GPLA в их положении SN2. cPLA 2 может также высвобождать лизофосфолипид, который становится фактором активации тромбоцитов .
Перекисное окисление и активные формы кислорода
Затем свободная жирная кислота насыщается кислородом по любому из нескольких путей; см. таблицу " Пути" . Пути эйкозаноидов ( через липоксигеназу или ЦОГ ) добавляют молекулярный кислород (O 2 ). Хотя жирная кислота симметрична , полученные эйкозаноиды хиральны ; окисления протекают с высокой стереоселективностью (ферментативные окисления считаются практически стереоспецифическими ).
Четыре семейства ферментов инициируют или способствуют инициированию катализа жирных кислот до эйкозаноидов:
- Циклооксигеназы (ЦОГ): ЦОГ-1 и ЦОГ-2 инициируют метаболизм арахидоновой кислоты до простаноидов, которые содержат две двойные связи, то есть простагландины (например, PGE2), простациклин (например, PGI2) и тромбоксаны (например, TXA2). Два фермента ЦОГ также инициируют метаболизм: а) эйкозапентаеновой кислоты , которая имеет 5 двойных связей по сравнению с 4 двойными связями арахидоновой кислоты, с продуктами простаноида, простациклина и тромбоксана, которые имеют три двойные связи, например PGE3, PGI3 и TXA3 и b) дигомо-γ-линоленовая кислота , которая имеет три двойные связи, с продуктами простаноида, простациклина и тромбоксана, которые имеют только одну двойную связь, например PGE1, PGI1 и TXA1.
- Липоксигеназы (LOX): 5-липоксигеназа (5-LOX или ALOX5) инициирует метаболизм арахидоновой кислоты до 5-гидропероксиэйкозатетраеновой кислоты (5-HpETE), которая затем может быстро восстановиться до 5-гидроксиэйкозатетраеновой кислоты (5-HETE) или подвергнуться дальнейшему метаболизму. к лейкотриенам (например, LTB4 и LTC4 ); 5-HETE может быть окислен до 5-оксо-эйкозатетраеновой кислоты (5-оксо-ETE). Аналогичным образом 15-липоксигеназа (15-липоксигеназа 1, 15-LOX, 15-LOX1 или ALOX15) инициирует метаболизм арахидоновой кислоты до 15-HpETE, 15-HETE, эоксинов , 8,15-дигидроксиэйкозатетраеновой кислоты (т.е. 8 , 15-DiHETE), а 15-оксо-ETE и 12-липоксигеназа (12-LOX или ALOX12) инициируют метаболизм арахидоновой кислоты до 12-HpETE, 12-HETE, гепоксилинов и 12-оксо-ETE. Эти ферменты также инициируют метаболизм; а ) эйкозапентаеновая кислота к аналогам метаболитов арахидоновой кислоты, которые содержат 5, а не четыре двойные связи, например, 5-гидрокси-эйкозапентаеновая кислота (5-HEPE), LTB5, LTC5, 5-оксо-EPE, 15-HEPE и 12- HEPE; б) дигомо-γ-линоленовой кислоты, содержащей три двойные связи, в продукты, которые содержат 3 двойные связи, например, 8-гидрокси-эйкозатриеновая кислота (8-HETrE), 12-HETrE и 15-HETrE (эта жирная кислота не может быть преобразована к лейкотриенам); и медовая кислота, содержащая три двойные связи (посредством ALOX5), с 5-гидроперокси-эйкозатриеновой кислотой (5-HpETrE), 5-HETrE и 5-оксо-HETrE. В наиболее изученных из этих путей ALOX5 метаболизирует эйкозапентаеновую кислоту до 5-гидропероксиэйкозапентаеновой кислоты (5-HpEPE), 5-HEPE, LTB5 и 5-оксо-EPE, все из которых менее активны, чем аналоги арахидоновой кислоты. Поскольку эйкозапентаеновая кислота конкурирует с арахидоновой кислотой за ALOX5, продукция метаболитов эйкозапентаеноата приводит к снижению метаболитов эйкозатетраеноата и, следовательно, снижению передачи сигналов последних метаболитов. Первоначальные моногидроперокси- и моногидроксипродукты, образованные вышеупомянутыми липоксигеназами, имеют свою гидроперозию и гидроксильные остатки, расположенные в хиральной конфигурации S, и их более правильно назвать 5 S -HpETE, 5 S -HETE, 12 S -HpETE, 12 S - HETE, 15 S -HPETE и 15 S -HETE. ALOX12B (т.е. арахидонат-12-липоксигеназа, тип 12R) образует продукты R- хиральности, то есть 12 R -HpETE и 12 R -HETE. Аналогично, ALOXE3 (т.е. липоксигеназа 3 эпидермисного типа или eLOX3) метаболизирует арахидоновую кислоту до 12 R -HpETE и 12 R -HETE; однако это второстепенные продукты, которые этот фермент образует только при ограниченном наборе условий. ALOXE3 предпочтительно метаболизирует арахидоновую кислоту до гепоксилинов.
- Эпоксигеназы : это ферменты цитохрома P450, которые образуют неклассические эпоксиды эйкозаноидов, полученные из: а) арахидоновой кислоты, а именно 5,6-эпокси-эйкозатриеновой кислоты (5,6-EET), 8,9-EET, 11,12-EET, и 14,15-EET (см. эпоксиэйкозатриеновая кислота ); б) эйкозапентаеновая кислота, а именно 5,6, -эпокси-эйкозатетраеновая кислота (5,6-EEQ), 8,9-EEQ, 11,12-EEQ, 14,15-EEQ и 17,18-EEQ (см. Эпоксиэйкозатетраеновая кислота ); c) дигомо-γ-линоленовая кислота, а именно 8,9-эпокси-эйкозадиеновая кислота (8,9-EpEDE), 11,12-EpEDE и 14,15-EpEDE; и d) адреновая кислота, а именно 7,8-эпокс-эйкозатриеновая кислота (7,8-EpETrR), 10,11-EpTrE, 13,14-EpTrE и 16,17-EpETrE. Все эти эпоксиды иногда быстро превращаются в свои дигидроксиметаболиты различными клетками и тканями. Например, 5,6-EET превращается в 5,6-дигидрокси-эйкозатриеновую кислоту (5,6-DiHETrE), 8,9-EEQ в 8,9-дигидрокси-эйкозатетраеновую кислоту (8,9-DiHETE, 11, 12-EpEDE к 11,12-дигидрокси-эйкозадиеновой кислоте (11,12DiHEDE) и 16,17-EpETrE к 16,17-дигидрокси-эйкозатриеновой кислоте (16,17-DiETrE
- Ω-гидроксилазы микросом цитохрома P450 : CYP4A11 , CYP4A22 , CYP4F2 и CYP4F3 метаболизируют арахидоновую кислоту в основном до 20-гидроксиэйкозатетраеновой кислоты (20-HETE), но также до 16-HETE, 17-HETE, 18-HETE и 19-HETE; они также метаболизируют эйкозапентаеновую кислоту в первую очередь до 20-гидрокси-эйкозапентаеновой кислоты (20-HEPE), но также и до 19-HEPE.
Два разных фермента могут последовательно воздействовать на ПНЖК с образованием более сложных метаболитов. Например, ALOX5 действует с ALOX12 или COX-2, обработанным аспирином, для метаболизма арахидоновой кислоты до липоксинов и с монооксигеназой (ами) цитохрома P450, бактериальным цитохромом P450 (в инфицированных тканях) или COX2, обработанным аспирином, для метаболизма эйкозапентаеновой кислоты до E серия resolvins (РВЭС) (см Специализированные про-разрешения посредников ). Когда это происходит с ферментами, расположенными в разных типах клеток, и включает перенос продукта одного фермента в клетку, которая использует второй фермент для производства конечного продукта, это называется трансцеллюлярным метаболизмом или трансцеллюлярным биосинтезом.
Окисление липидов опасно для клеток, особенно вблизи ядра. Существуют тщательно продуманные механизмы предотвращения нежелательного окисления. ЦОГ, липоксигеназы и фосфолипазы строго контролируются - по крайней мере восемь белков активированы для координации генерации лейкотриенов. Некоторые из них существуют в нескольких изоформах .
Окисление ЦОГ или липоксигеназой высвобождает активные формы кислорода (АФК), а исходные продукты образования эйкозаноидов сами по себе являются высокореактивными пероксидами . LTA 4 может образовывать аддукты с тканевой ДНК . Другие реакции липоксигеназ вызывают повреждение клеток; мышиные модели вовлекают 15-липоксигеназы в патогенезе от атеросклероза . Окисление при образовании эйкозаноидов разделено на части; это ограничивает повреждение пероксидов. Ферменты , которые являются биосинтетическими эйкозаноид (например, глутатион-S-трансфераз , эпоксидными гидролаз и белками - носителей ) принадлежат семьям , чьи функции в значительной степени участвуют в клеточной детоксикации. Это предполагает, что передача сигналов эйкозаноидов могла возникнуть в результате детоксикации АФК.
Клетка должна получать некоторую выгоду от генерации гидропероксидов липидов рядом с ядром. PG и LT могут там сигнализировать или регулировать транскрипцию ДНК ; LTB 4 является лигандом PPARα . (См. Диаграмму в PPAR ).
Простаноидные пути
И COX1, и COX2 (также называемые простагландин-эндопероксидсинтазой-1 ( PTGS1 ) и PTGS2 соответственно) метаболизируют арахидоновую кислоту, добавляя молекулярный O 2 между атомами углерода 9 и 11 с образованием эндопероксидного мостика между этими двумя атомами углерода, добавляя молекулярный O 2 к углероду. 15, чтобы получить 15-гидропероксипродукт, создавая углерод-углеродную связь между атомами углерода 8 и 12, чтобы создать циклопентановое кольцо в середине жирной кислоты, и в процессе получения PGG2, продукта, который имеет на две двойных связи меньше, чем арахидоновая кислота. кислота. Затем 15-гидроперокси-остаток PGG2 восстанавливается до 15- гидроксильного остатка, тем самым образуя PGH2. PGH2 является родительским простаноидом для всех других простаноидов. Он метаболизируется (см диаграммы в простаноидах : а) синтазы простагландин Х путей в которой любые один из трех изоферментов , PTGES , PTGES2 или PTGES3 , обращенный PGH2 к PGE2 (последующим продуктам этого пути включают PGA2 и PGB2 (см простаноидов # Биосинтез ); б) PGF-синтаза, которая превращает PGH2 в PGF2α; c) простагландин D2-синтаза, которая превращает PGH2 в PGD2 (последующие продукты на этом пути включают 15-dPGJ2 (см. Циклопентенон простагландин ); d) тромбоксансинтаза, которая превращает PGH2 в TXA2 (последующие продукты на этом пути включают TXB2); и e) простациклинсинтаза, которая превращает PGH2 в PGI2 (последующие продукты этого пути включают 6-кето-PGFα. Было показано или в некоторых случаях предполагается, что эти пути метаболизируют эйкозапентаеновую кислоту до эйкозаноидных аналогов указанных продуктов, которые имеют три, а не два двойные связи и, следовательно, содержат цифру 3 вместо 2, прикрепленную к их названиям (например, PGE3 вместо PGE2).
Продукты PGE2, PGE1 и PGD2, образующиеся в только что упомянутых путях, могут подвергаться реакции спонтанной дегидратации с образованием PGA2, PGA1 и PGJ2 соответственно; PGJ2 может затем подвергаться спонтанной изомеризации с последующей реакцией дегидратации с образованием последовательно Δ12-PGJ2 и 15-дезокси-Δ12,14-PGJ2.
PGH2 имеет 5-углеродное кольцо, соединенное мостиком молекулярного кислорода. Его производные PGS потеряли этот кислородный мостик и содержат одно ненасыщенное 5-углеродное кольцо, за исключением тромбоксана А2, который обладает 6-членным кольцом, состоящим из одного кислорода и 5 атомов углерода. 5-углеродное кольцо простациклина соединено со вторым кольцом, состоящим из 4 атомов углерода и одного атома кислорода. И 5-членное кольцо простагландинов циклопентенона обладает ненасыщенной связью в конъюгированной системе с карбонильной группой, которая заставляет эти PG образовывать связи с разнообразным набором биоактивных белков (подробнее см. Диаграммы на Простаноиде ).
Гидроксиэйкозатетраеноатный (HETE) и лейкотриеновый (LT) пути
См. « Синтез лейкотриена» , « Гидроксиэйкозатетраеновая кислота» и « Эоксин-биосинтез человека» .
Фермент 5-липоксигеназа (5-LO или ALOX5) превращает арахидоновую кислоту в 5-гидропероксиэйкозатетраеновую кислоту (5-HPETE), которая может высвобождаться и быстро восстанавливаться до 5-гидроксиэйкозатетраеновой кислоты (5-HETE) повсеместно распространенными клеточными глутатион- зависимыми пероксидазами. . Альтернативно, ALOX5 использует свою активность LTA-синтазы для преобразования 5-HPETE в лейкотриен A 4 (LTA 4 ). Затем LTA4 метаболизируется либо до LTB 4 под действием лейкотриеновой гидролазы A4, либо до лейкотриена C4 (LTC4) посредством либо LTC4-синтазы, либо микросомальной глутатион-S-трансферазы 2 ( MGST2 ). Любой из последних двух ферментов присоединяет серу тио- (т.е. SH) группы цистеина в трипептиде глутамат - цистеин - глицин к углероду 6 LTA4, тем самым образуя LTC4. После высвобождения из его родительской клетки остатки глутамата и глицина LTC4 поэтапно удаляются гамма-глутамилтрансферазой и дипептидазой с образованием последовательно LTD4 и LTE4 . Решение сформировать LTB4 по сравнению с LTC4 зависит от относительного содержания гидролазы LTA4 по сравнению с LTC4-синтазой (или глутатион-S-трансферазой в клетках; эозинофилы , тучные клетки и альвеолярные макрофаги обладают относительно высокими уровнями LTC4-синтазы и, соответственно, образуют LTC4, а не или в гораздо большей степени, чем LTB4. 5-LOX может также работать последовательно с оксигеназами цитохрома P450 или COX2, обработанным аспирином, с образованием резолвинов RvE1, RvE2 и 18S-RvE1 (см. Специализированные про-разрешающие медиаторы # резолвины, производные от EPA ).
Фермент арахидонат-12-липоксигеназа (12-LO или ALOX12) метаболизирует арахидоновую кислоту до S- стереоизомера 12-гидропероксиэйкозатетраеновой кислоты (12-HPETE), который быстро восстанавливается клеточными пероксидазами до S- стереоизомера 12-гидроксиэйкозатетраеновой кислоты (12-HEPETE). ) или далее метаболизируется до гепоксилинов (Hx), таких как HxA3 и HxB.
Ферменты 15-липоксигеназа -1 (15-LO-1 или ALOX15 ) и 15-липоксигеназа-2 (15-LO-2, ALOX15B ) метаболизируют арахидоновую кислоту до S- стереоизомера 15-гидропероксиэйкозатетраеновой кислоты (15 (S) -HPETE ), который быстро восстанавливается клеточными пероксидазами до S- стереоизомера 15-гидроксикозатетраеновой кислоты (15 (S) -HETE). 15-липоксигеназы (особенно ALOX15) могут также действовать последовательно с 5-липоксигеназой, 12-липоксигеназой или COX2, обработанным аспирином, с образованием липоксинов и эпилипоксинов, или с оксигеназами P450, или COX2, обработанными аспирином, с образованием Resolvin E3 (см. Специализированные про-разрешающие медиаторы # Резолвины, производные от EPA .
Подмножество ω-гидроксилаз, связанных с микросомами цитохрома P450 (CYP450) (см. 20-гидроксиэйкозатетраеновая кислота ), метаболизируют арахидоновую кислоту до 20-гидроксиэйкозатетраеновой кислоты (20-HETE) и 19-гидроксиэйкозатетраеновой кислоты путем реакции омега-окисления .
Эпоксиэйкозаноидный путь
Человеческий цитохром Р450 (CYP) epoxygenases, CYP1A1, CYP1A2, CYP2C8, CYP2C9, CYP2C18, CYP2C19, CYP2E1, CYP2J2 и CYP2S1 метаболизм арахидоновой кислоты к неклассическому Epoxyeicosatrienoic кислотам (EETs) путем преобразования одного из жирной кислоты в двойных связях с его эпоксид с образованием одного или нескольких из следующих EET, 14,15-ETE, 11,12-EET, 8,9-ETE и 4,5-ETE. 14,15-EET и 11,12-EET являются основными EET, продуцируемыми тканями млекопитающих, включая человека. Те же CYP, но также CYP4A1, CYP4F8 и CYP4F12 метаболизируют эйкозапентаеновую кислоту до пяти эпоксидных эпоксиэйкозатетраеновых кислот (EEQ), а именно 17,18-EEQ, 14,15-EEQ, 11,12-EEQ. 8,9-EEQ и 5,6-EEQ (см. Эпоксиэйкозатетраеновая кислота ).
Функция, фармакология и клиническое значение
В следующей таблице перечислены основные эйкозаноиды, которые обладают клинически значимой биологической активностью, клеточные рецепторы (см. Рецептор клеточной поверхности ), которые они стимулируют или, если отмечено, противодействуют для достижения этой активности, некоторые из основных функций, которые они регулируют (либо стимулировать или ингибировать) на моделях людей и мышей, а также некоторые из их значимости для болезней человека.
| Эйкозаноид | Целевые рецепторы | Функции регулируются | Клиническая значимость |
|---|---|---|---|
| PGE2 | PTGER1 , PTGER2 , PTGER3 , PTGER4 | воспаление; высокая температура; восприятие боли; аллодиния ; роды | НПВП подавляют его выработку, уменьшая воспаление, жар и боль; используется для поощрения родов; абортивных |
| PGD2 | Рецептор простагландина DP1 1, рецептор простагландина DP2 | аллергические реакции; аллодиния ; рост волос | НПВП могут быть нацелены на него, чтобы подавить аллодинию и выпадение волос по мужскому типу. |
| TXA2 | Тромбоксановые рецепторы α и β | агрегация тромбоцитов в крови ; свертывание крови; аллергические реакции | НПВП подавляют его выработку, снижая частоту инсультов и сердечных приступов. |
| PGI2 | Рецептор простациклина | агрегация тромбоцитов, сокращение гладких мышц сосудов | Аналоги PGI2, используемые для лечения сосудистых заболеваний, таких как легочная гипертензия , синдром Рейно и болезнь Бюргера. |
| 15-д-Δ12,14-PGJ2 | PPARγ , рецептор простагландина DP2 | подавляет воспаление и рост клеток | Подавляет различные воспалительные реакции на животных моделях; структурная модель для разработки противовоспалительных агентов |
| 20-HETE | ? | сужение сосудов, угнетает тромбоциты | инактивирующие мутации в ферменте, формирующем 20-HETE, CYP2U1 , связанные с наследственной спастической параплегией |
| 5-Oxo-ETE | OXER1 | хемотаксический фактор и активатор эозинофилов | исследования, необходимые для определения того, подавляет ли ингибирование его производства или действия аллергические реакции |
| LTB4 | LTB4R , LTB4R2 | хемотаксический фактор и активатор лейкоцитов; воспаление | на сегодняшний день исследования не показали явных преимуществ антагонистов рецептора LTB4 при воспалительных заболеваниях человека. |
| LTC4 | CYSLTR1 , CYSLTR2 , GPR17 | сосудистая проницаемость; сокращение гладких мышц сосудов; аллергия | антагонисты CYSLTR1, используемые при астме, а также других аллергических и аллергических реакциях |
| LTD4 | CYSLTR1 , CYSLTR2 , GPR17 | сосудистая проницаемость; сокращение гладких мышц сосудов; аллергия | антагонисты CYSLTR1, используемые при астме, а также других аллергических и аллергических реакциях |
| LTE4 | GPR99 | увеличивает проницаемость сосудов и секрецию муцина в дыхательных путях | считается, что способствует астме, а также другим аллергическим и аллергическим реакциям |
| LxA4 | FPR2 | подавляет функции провоспалительных клеток | Специализированный класс медиаторов, способствующих рассасыванию, супрессоров воспалительной реакции. |
| LxB4 | FPR2 , GPR32 , AHR | подавляет функции провоспалительных клеток | Специализированный класс медиаторов, способствующих рассасыванию, супрессоров воспалительной реакции. |
| RvE1 | CMKLR1 , ингибирует BLT , TRPV1 , TRPV3 , NMDAR , TNFR | подавляет функции провоспалительных клеток | Класс специализированных про-рассасывающихся медиаторов супрессоров воспалительной реакции; также подавляет восприятие боли |
| RvE2 | CMKLR1 , антагонист рецептора из BLT | подавляет функции провоспалительных клеток | Специализированный класс медиаторов, способствующих рассасыванию, супрессоров воспалительной реакции. |
| 14,15-EET | ? | расширение сосудов , подавляет тромбоциты и провоспалительные клетки | роль (и) в заболевании человека еще не доказана |
Простаноиды
Известно, что многие простаноиды опосредуют местные симптомы воспаления : сужение или расширение сосудов , коагуляцию , боль и лихорадку . Ингибирование ЦОГ-1 и / или индуцибельных изоформ ЦОГ-2 является отличительной чертой НПВП (нестероидных противовоспалительных средств), таких как аспирин . Простаноиды также активируют PPAR- γ членов семейства стероидных / тироидных рецепторов ядерных гормонов и напрямую влияют на транскрипцию генов . Простаноиды имеют множество других значений для клинической медицины в качестве доказательства их использования, использования их более стабильных фармакологических аналогов, использования их антагонистов рецепторов, как показано в следующей таблице.
| Медицина | Тип | Состояние здоровья или использование | Медицина | Тип | Состояние здоровья или использование | |
|---|---|---|---|---|---|---|
| Алпростадил | PGE1 | Эректильная дисфункция , поддержание открытого артериального протока у плода | Берапрост | Аналог PGI1 | Легочная гипертензия , избегая реперфузионного повреждения | |
| Биматопрост | PGF2α аналог | Глаукома , глазная гипертензия | Карбопрост | PGF2α аналог | Индукция родов, абортивное средство на ранних сроках беременности | |
| Динопростон | PGE2 | индукция родов | Илопрост | PGI2 аналог | легочная артериальная гипертензия | |
| Латанопрост | PGF2α аналог | Глаукома , глазная гипертензия | Мизопростол | PGE1 аналог | язвенная болезнь желудка индукция родов , абортивное средство | |
| Травопрост | PGF2α аналог | Глаукома , глазная гипертензия | U46619 | Более долгоживущий аналог TX Более долгоживущий аналог TX | Только исследования |
Циклопентенон простагландины
PGA1, PGA2, PGJ2, Δ12-PGJ2 и 15-deox-Δ12,14-PGJ2 проявляют широкий спектр противовоспалительных и противовоспалительных действий на различных животных моделях. Следовательно, они, по-видимому, действуют аналогично специализированным про-разрешающим медиаторам, хотя один из механизмов их действия, формирующий ковалентные связи с ключевыми сигнальными белками, отличается от таковых у специализированных про-разрешающих медиаторов.
HETE и оксо-ETE
Как указано в их отдельных страниц Wikipedia, 5-hydroxyeicosatetraenoic кислоты (который, как и 5-оксо-эйкозатетраеновая кислоты, действует через рецептор OXER1), 5-оксо-эйкозатетраеновая кислоты , 12-Hydroxyeicosatetraenoic кислоты , 15-Hydroxyeicosatetraenoic кислоты , и 20- Гидроксиэйкозатетраеновая кислота проявляет многочисленные активности в клетках животных и человека, а также в моделях животных, которые связаны, например, с воспалением, аллергическими реакциями, ростом раковых клеток, кровотоком в тканях и / или кровяным давлением. Однако их функция и актуальность для физиологии и патологии человека еще не доказаны.
Лейкотриены
Три цистеиниловых лейкотриена, LTC4, LTD4 и LTE4, являются мощными бронхоконстрикторами, увеличивают проницаемость сосудов в посткапиллярных венулах и стимуляторами секреции слизи, которая выделяется из ткани легких астматиков, подвергающихся воздействию определенных аллергенов. Они играют патофизиологическую роль в различных типах реакций гиперчувствительности немедленного типа . Лекарства, которые блокируют активацию рецептора CYSLTR1, а именно монтелукаст , зафирлукаст и пранлукаст , используются в клинической практике в качестве поддерживающего лечения астмы и ринита, вызванного аллергеном ; астма и ринит, вызванные приемом нестероидных противовоспалительных препаратов (см. Аспириновая астма ); астма, вызванная физической нагрузкой и холодным воздухом (см. Бронхоспазм, вызванный физической нагрузкой ); и апноэ во сне у детей, вызванное гипертрофией аденотонзилляров (см. Приобретенная невоспалительная миопатия # Диета и Миопатия, вызванная травмой ). В сочетании с антигистаминной лекарственной терапией они также оказываются полезными для лечения уртикарных заболеваний, таких как крапивница.
Липоксины и эпи-липоксины
LxA4, LxB4, 15-epi-LxA4 и 15-epi-LXB4, как и другие представители класса эйкозаноидов ( специализированных про-разрешающих медиаторов ), обладают противовоспалительной и разрешающей воспаление активностью. В рандомизированном контролируемом исследовании AT-LXA4 и сравнительно стабильный аналог LXB4, 15 R / S -метил-LXB4, снижали тяжесть экземы в исследовании с 60 младенцами, а в другом исследовании ингаляционный LXA4 уменьшал бронхопровокацию, инициированную LTC4. у больных бронхиальной астмой.
Эоксины
Эоксины (EXC4, EXD4, EXE5) описаны заново. Они стимулируют проницаемость сосудов в модельной системе сосудистого эндотелия человека ex vivo, и в небольшом исследовании с участием 32 добровольцев продукция EXC4 эозинофилами, изолированными от тяжелых астматиков и астматиков с непереносимостью аспирина, была выше, чем у здоровых добровольцев и пациентов с легкой астмой; Предполагается, что эти результаты указывают на то, что эоксины обладают провоспалительным действием и, следовательно, потенциально участвуют в различных аллергических реакциях. Производство эоксинов клетками Рида-Штернбурга также привело к предположению, что они участвуют в болезни Ходжкина . Однако клиническое значение эоксинов еще не доказано.
Резолвин метаболиты эйкозапентаеновой кислоты
RvE1, 18S-RvE1, RvE2 и RvE3, как и другие представители класса эйкозаноидов (специализированных про-разрешающих медиаторов), обладают противовоспалительной и разрешающей воспаление активностью. Синтетический аналог RvE1 проходит клиническую фазу III тестирования (см. « Фазы клинических исследований» ) для лечения синдрома сухого глаза на основе воспаления ; Наряду с этим исследованием проводятся другие клинические испытания (NCT01639846, NCT01675570, NCT00799552 и NCT02329743) с использованием аналога RvE1 для лечения различных глазных состояний. RvE1 также проходит клинические исследования для лечения нейродегенеративных заболеваний и потери слуха.
Другие метаболиты эйкозапентаеновой кислоты
Метаболиты эйкозапентаеновой кислоты, которые являются аналогами их простаноидов, полученных из арахидоновой кислоты, HETE и LT, включают: простаноиды 3-го ряда (например, PGE3, PGD3, PGF3α, PGI3 и TXA3), гидроксиэйкозапентаеновые кислоты (например, 5-HEPE , 12-HEPE, 15-HEPE и 20-HEPE) и LTE 5-й серии (например, LTB5, LTC5, LTD5 и LTE5). Было показано, что многие из простаноидов 3-й серии, гидроксиэйкозапентаеновые кислоты и LT 5-й серии являются более слабыми стимуляторами своих клеток-мишеней и тканей, чем их аналоги, производные арахидоновой кислоты. Им предлагается уменьшить действие аналогов, производных от ацидоната, путем замены их производства более слабыми аналогами. Аналоги эоксинов, производные эйкозапентаеновой кислоты, не описаны.
Эпоксиэйкозаноиды
Эпокси-эйкостриеновые кислоты (или EET) - и, предположительно, эпокси-эйкозатетраеновые кислоты - оказывают сосудорасширяющее действие на сердце, почки и другие кровеносные сосуды, а также на реабсорбцию почками натрия и воды и снижают кровяное давление и вызывают ишемию. и другие травмы сердца, мозга и других тканей; они также могут уменьшать воспаление, способствовать росту и метастазированию некоторых опухолей, способствовать росту новых кровеносных сосудов, в центральной нервной системе регулировать высвобождение нейропептидных гормонов, а в периферической нервной системе подавлять или уменьшать восприятие боли.
Серии ω-3 и ω-6
Снижение эйкозаноидов, производных АК, и пониженная активность альтернативных продуктов, генерируемых из жирных кислот ω-3, служат основой для объяснения некоторых положительных эффектов увеличения потребления ω-3.
- Кевин Фриче, жирные кислоты как модуляторы иммунного ответа.
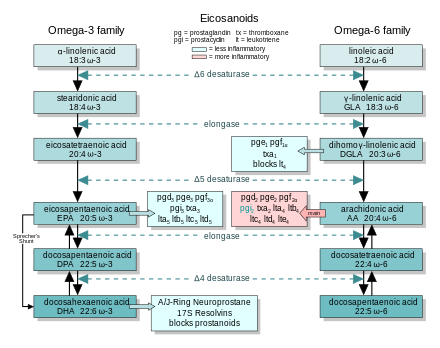
Арахидоновая кислота (AA; 20: 4 ω-6) находится во главе «каскада арахидоновой кислоты» - более двадцати опосредованных эйкозаноидами сигнальных путей, контролирующих широкий спектр клеточных функций, особенно те, которые регулируют воспаление , иммунитет и центральную нервную систему. нервная система .
При воспалительной реакции две другие группы пищевых жирных кислот образуют каскады, которые параллельны каскаду арахидоновой кислоты и конкурируют с ним. EPA (20: 5 ω-3) обеспечивает наиболее важный конкурирующий каскад. DGLA (20: 3 ω-6) обеспечивает третий, менее заметный каскад. Эти два параллельных каскада смягчают воспалительные эффекты АК и его продуктов. Низкое потребление с пищей этих менее вызывающих воспаление жирных кислот, особенно ω-3, было связано с рядом заболеваний, связанных с воспалением, и, возможно, с некоторыми психическими заболеваниями .
США Национальный институт здоровья и Национальная библиотека медицины утверждают , что есть доказательства уровня «А» , что повышенное потребление ω-3 улучшает результаты в гипертриглицеридемия , вторичные сердечно - сосудистые заболевания профилактика и гипертонии . Имеются доказательства уровня «B» («хорошие научные доказательства») увеличения содержания ω-3 в рационе для первичной профилактики сердечно-сосудистых заболеваний, ревматоидного артрита и защиты от токсичности циклоспорина у пациентов с трансплантированными органами . Они также отмечают более предварительные доказательства того, что диетический ω-3 может облегчить симптомы при некоторых психических расстройствах.
Помимо влияния на эйкозаноиды, пищевые полиненасыщенные жиры модулируют иммунный ответ посредством трех других молекулярных механизмов. Они (а) изменяют состав и функцию мембран , включая состав липидных рафтов ; (б) изменить биосинтез цитокинов ; и (c) непосредственно активировать транскрипцию гена. Из них лучше всего изучено действие на эйкозаноиды.
Механизмы действия ω-3
В целом, эйкозаноиды, полученные из АК, способствуют воспалению, а эйкозаноиды из EPA и GLA ( через DGLA) менее воспалительные, или неактивные, или даже противовоспалительные и способствующие рассасыванию .
На рисунке показаны цепи синтеза ω-3 и -6, а также основные эйкозаноиды из AA, EPA и DGLA.
Диетический ω-3 и ГЛК противодействуют воспалительным эффектам эйкозаноидов АК тремя способами, действующими на пути эйкозаноидов:
- Вытеснение - диетический ω-3 снижает концентрацию АК в тканях, поэтому образование ω-6 эйкозаноидов меньше.
- Конкурентное ингибирование - DGLA и EPA конкурируют с AA за доступ к ферментам циклооксигеназы и липоксигеназы. Таким образом, присутствие DGLA и EPA в тканях снижает выход эйкозаноидов АК.
- Противодействие. Некоторые эйкозаноиды, полученные из DGLA и EPA, противодействуют своим аналогам, полученным из АА.
Роль в воспалении
С древних времен основные признаки воспаления были известны как калор (тепло), dolor (боль), опухоль (опухоль) и rubor (покраснение). Эйкозаноиды связаны с каждым из этих признаков.
Покраснение - укус насекомого вызывает классический воспалительный ответ. Быстродействующих сосудосуживающие - ТХА 2 -Вы быстро освобожден после травмы. Сайт может на мгновение побледнеть. Затем TXA 2 опосредует высвобождение вазодилататоров PGE 2 и LTB 4 . Кровеносные сосуды набухают, и рана краснеет.
Набухание —LTB 4 делает кровеносные сосуды более проницаемыми. Плазма просачивается в соединительные ткани, и они набухают. В процессе также теряются провоспалительные цитокины.
Боль -The цитокины увеличивают активность СОХ-2. Это повышает уровень PGE 2 , сенсибилизируя нейроны боли.
Тепло - ПГЕ 2 также является сильнодействующим пиретическим агентом. Аспирин и НПВП - препараты, которые блокируют пути ЦОГ и останавливают синтез простаноидов - ограничивают лихорадку или жар локализованного воспаления.
История
В 1930 году гинеколог Рафаэль Курцрок и фармаколог Чарльз Лейб охарактеризовали простагландин как компонент спермы. Между 1929 и 1932 годами Бёрр и Бёрр показали, что ограничение употребления жиров в рационе животных приводит к болезни дефицита, и впервые описали незаменимые жирные кислоты . В 1935 году фон Эйлер идентифицировал простагландин. В 1964 году Бергстрём и Самуэльссон соединили эти наблюдения, когда они показали, что «классические» эйкозаноиды были производными арахидоновой кислоты, которая ранее считалась одной из незаменимых жирных кислот. В 1971 году Вейн показал, что аспирин и подобные препараты подавляют синтез простагландинов. Фон Эйлер получил Нобелевскую премию по медицине в 1970 году, которую Самуэльссон, Вейн и Бергстрём также получили в 1982 году. Э. Дж. Кори получил ее по химии в 1990 году в основном за синтез простагландинов.
Смотрите также
использованная литература
внешние ссылки
- Эйкозаноиды в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)