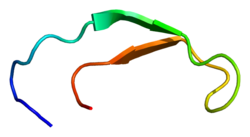Гепсидин - Hepcidin
| Гепсидин | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Структура раствора гепсидина-25.
| |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | Гепсидин | ||||||||
| Pfam | PF06446 | ||||||||
| ИнтерПро | IPR010500 | ||||||||
| SCOP2 | 1м4ф / СФЕРА / СУПФАМ | ||||||||
| OPM суперсемейство | 153 | ||||||||
| Белок OPM | 1м4э | ||||||||
| |||||||||
| противомикробный пептид гепсидина | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Условное обозначение | HAMP | ||||||
| Ген NCBI | 57817 | ||||||
| HGNC | 15598 | ||||||
| OMIM | 606464 | ||||||
| RefSeq | NM_021175 | ||||||
| UniProt | P81172 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 19 q13.1 | ||||||
| |||||||
Гепсидин - это белок, который у человека кодируется геном HAMP . Гепсидин является ключевым регулятором поступления железа в кровообращение у млекопитающих.
В условиях аномально высокого уровня гепсидина, таких как воспаление , сывороточное железо падает из-за захвата железа макрофагами и клетками печени и снижения всасывания железа в кишечнике. Это обычно приводит к анемии из-за недостаточного количества сывороточного железа, доступного для развития красных кровяных телец . Когда уровень гепсидина аномально низкий, например, при гемохроматозе , возникает перегрузка железом из-за повышенного оттока железа, опосредованного ферропортином, из хранилищ и увеличения абсорбции железа в кишечнике.
Состав
Гепсидин существует в виде препрогормона (84 аминокислоты), прогормона (60 аминокислот) и гормона (25 аминокислот). Метаболиты гепсидина из двадцати и 22 аминокислот также присутствуют в моче. Удаление 5 N -концевых аминокислот приводит к потере функции. Превращение прогепсидина в гепсидин опосредуется прогормон-конвертазой фурином . Это превращение может регулироваться альфа-1- антитрипсином .
Гепсидин представляет собой плотно свернутый полипептид с 32% -ным бета-листовым характером и структурой шпильки, стабилизированной 4-мя дисульфидными связями . Структура гепсидина была определена с помощью ЯМР в растворе . ЯМР-исследования показали новую модель гепсидина: при температуре окружающей среды белок взаимно преобразуется между двумя конформациями, которые можно индивидуально разрешить путем изменения температуры. Структура раствора гепсидина определялась при 325 и 253 К в переохлажденной воде. Рентгеноструктурный анализ сокристалла с Fab выявил структуру, аналогичную структуре высокотемпературного ЯМР.
Функция
Гепсидин - регулятор обмена железа. Он ингибирует транспорт железа, связываясь с ферропортином канала экспорта железа, который расположен в базолатеральной плазматической мембране кишечных энтероцитов и плазматической мембране ретикулоэндотелиальных клеток ( макрофагов ), что в конечном итоге приводит к разрушению ферропортина в лизосомах . Ингибирование ферропортина предотвращает экспорт железа из клетки. В энтероцитах это предотвращает передачу железа в портальную систему печени , тем самым снижая всасывание железа с пищей. В макрофагах ингибирование ферропортина вызывает секвестрацию железа внутри клетки. Повышенная активность гепсидина частично отвечает за снижение доступности железа, наблюдаемое при анемии хронического воспаления, такой как почечная недостаточность .
Любая из нескольких мутаций гепсидина приводит к ювенильному гемохроматозу . Большинство случаев ювенильного гемохроматоза связано с мутациями гемоювелина . Мутации в TMPRSS6 могут вызывать анемию из-за нарушения регуляции гепсидина.
Гепсидин обладает сильным антимикробным действием против штамма Escherichia coli ML35P и Neisseria cinerea и более слабым противомикробным действием против Staphylococcus epidermidis , Staphylococcus aureus и Streptococcus agalactiae . Он также активен против грибка Candida albicans , но не проявляет активности против синегнойной палочки .
Регулирование
Синтез и секреция гепсидина печенью контролируется запасами железа в макрофагах, воспалением (гепсидин является реагентом острой фазы ), гипоксией и эритропоэзом . Макрофаги связываются с гепатоцитом, чтобы регулировать высвобождение гепсидина в кровоток с помощью восьми различных белков: гемоювелина , белка наследственного гемохроматоза, рецептора трансферрина 2 , костного морфогенного белка 6 (BMP6), матриптазы-2, неогенина, рецепторов BMP и трансферрина .
Эритроферрон , продуцируемый в эритробластах, был идентифицирован как ингибитор гепсидина и, таким образом, обеспечивает большее количество железа для синтеза гемоглобина в таких ситуациях, как стрессовый эритропоэз.
Было показано, что витамин D снижает уровень гепсидина на клеточных моделях, изучающих транскрипцию, и при введении в больших дозах людям-добровольцам. Оптимальная функция гепсидина может быть основана на адекватном присутствии витамина D в крови.
История
Первоначально о пептиде сообщили в январе 1998 г. Valore, E., Park, C. и Ганц Т. в базе данных SWISS-PROT под номером P81172 и назван гепсидином после того, как было обнаружено, что он продуцируется в печени («геп-») и, по-видимому, обладает бактерицидными свойствами («-цид» для «уничтожения»). Подробные описания были опубликованы в 2000-2001 гг. Хотя он в основном синтезируется в печени, меньшие количества синтезируются в других тканях, таких как жировые клетки.
Гепцидин был впервые обнаружен в человеческой мочи и сыворотки Вскоре после этого открытия, исследователи обнаружили , что гепсидин производства в мышей возрастает в условиях перегрузки железом, а также в воспалении. Генетически модифицированные мыши, сконструированные для сверхэкспрессии гепсидина, умерли вскоре после рождения от тяжелого дефицита железа, что снова указывает на центральную, а не избыточную роль в регуляции железа. Первое доказательство того, что гепсидин связан с клиническим состоянием, известным как анемия воспаления, было получено в лаборатории Нэнси Эндрюс в Бостоне, когда исследователи изучили ткани двух пациентов с опухолями печени с тяжелой микроцитарной анемией, которые не реагировали на добавки железа . Ткань опухоли, по-видимому, сверхпродуцирует гепсидин и содержит большое количество мРНК гепсидина . Удаление опухолей хирургическим путем вылечило анемию.
Взятые вместе, эти открытия показали, что гепсидин регулирует всасывание железа в организме.
Клиническое значение
Есть много заболеваний, при которых недостаточное усвоение железа способствует железодефицитной анемии и железодефицитной анемии . Лечение будет зависеть от присутствующих уровней гепсидина, поскольку пероральное лечение вряд ли будет эффективным, если гепсидин блокирует энтеральную абсорбцию, и в таких случаях было бы целесообразно парентеральное лечение железом . Исследования показали, что измерение гепсидина было бы полезным для выбора оптимального лечения, хотя, поскольку он не является широко доступным, С-реактивный белок (СРБ) используется в качестве суррогатного маркера.
β-талассемия , одна из наиболее распространенных врожденных анемий , возникает из-за частичного или полного отсутствия синтеза β-глобина. Избыточное всасывание железа является одним из основных признаков β-талассемии и может привести к тяжелой заболеваемости и смертности. Серийные анализы мышей с β-талассемией показывают, что уровни гемоглобина со временем снижаются, в то время как концентрация железа в печени , селезенке и почках заметно увеличивается. Перегрузка железом связана с низким уровнем гепсидина. У пациентов с β-талассемией также низкий уровень гепсидина. Наблюдения привели исследователей к предположению, что при β-талассемии всасывается больше железа, чем требуется для эритропоэза . Повышение экспрессии гепсидина у мышей с β-талассемией ограничивает перегрузку железом, а также снижает образование нерастворимых мембраносвязанных глобинов и активных форм кислорода, а также улучшает анемию. Мыши с повышенной экспрессией гепсидина также продемонстрировали увеличение продолжительности жизни их эритроцитов , изменение неэффективного эритропоэза и спленомегалии , а также увеличение общего уровня гемоглобина . Основываясь на этих данных, исследователи предположили, что терапевтические средства, повышающие уровень гепсидина или действующие как агонисты гепсидина , могут помочь в лечении аномального всасывания железа у людей с β-талассемией и связанными с ним расстройствами. В более поздних исследованиях на мышах было высказано предположение , что эритроферрон является фактором, ответственным за подавление гепсидина. Коррекция уровней гепсидина и железа у этих мышей не улучшила их анемию.
использованная литература
дальнейшее чтение
- Камашелла C (2005). «Понимание гомеостаза железа посредством генетического анализа гемохроматоза и связанных с ним заболеваний» . Кровь . 106 (12): 3710–7. DOI : 10.1182 / кровь-2005-05-1857 . PMID 16030190 .
внешние ссылки
- гепсидин в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Intrinsic LifeSciences - Исследовательский центр гепсидина, компания BioIron
- Hepcidinanalysis.com - Сервис для измерения гепсидина: научные исследования, пациенты и клинические испытания
- Страница банка данных белков
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для человеческого гепсидина.