IgA нефропатия - IgA nephropathy
| IgA нефропатия | |
|---|---|
| Другие имена | IgA нефрит, болезнь Бергера |
 | |
| Димер иммуноглобулина А | |
| Специальность |
Нефрология Ревматология Онкология |
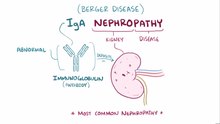
IgA - нефропатия ( ИГАН ), также известная как болезнь Бергера ( / б ɛər ʒ eɪ / ) (и варианты), или synpharyngitic гломерулонефрит , является заболеванием почек (или нефропатии) и системы иммунитета ; в частности , он является формой гломерулонефрита или воспаление из клубочков в почках . Агрессивная болезнь Бергера (более редкая форма болезни) может поражать другие важные органы, такие как печень , кожа и сердце .
IgA-нефропатия - самый распространенный гломерулонефрит во всем мире; однако агрессивная болезнь Бергера находится в списке редких заболеваний NORD . Первичная IgA-нефропатия характеризуется отложением IgA- антител в клубочках. Есть и другие заболевания, связанные с отложениями IgA в клубочках, наиболее распространенным из которых является васкулит IgA (ранее известный как пурпура Геноха – Шенлейна [HSP]), который многие считают системной формой нефропатии IgA. IgA-васкулит проявляется характерной пурпурной кожной сыпью, артритом и болями в животе и чаще встречается у детей. HSP ассоциируется с более благоприятным прогнозом, чем IgA-нефропатия. При неагрессивной IgA-нефропатии традиционно наблюдается медленное прогрессирование хронической почечной недостаточности в 25–30% случаев в течение 20 лет.
Признаки и симптомы
Классическим проявлением неагрессивной формы (в 40–50% случаев) является эпизодическая гематурия , которая обычно начинается в течение одного-двух дней после неспецифической инфекции верхних дыхательных путей (отсюда синфарингит ), в отличие от пост- стрептококковый гломерулонефрит , который возникает через некоторое время (недели) после первоначального заражения. Как при агрессивной, так и при неагрессивной болезни Бергера также могут возникать боли в пояснице . Макрогематурия может исчезнуть через несколько дней, хотя микроскопическая гематурия будет сохраняться, однако при агрессивной болезни Бергера чаще сохраняется макрогематурия, чем микроскопическая гематурия. Почечная функция обычно остается нормальной при неагрессивной болезни Бергера, хотя в редких случаях может возникнуть острая почечная недостаточность (см. Ниже). Это представление чаще встречается у молодых людей.
Меньшая часть (20–30%), обычно пожилое население, страдает микроскопической гематурией и протеинурией (менее 2 г / день). Эти пациенты могут протекать бессимптомно и забираться только на основании анализа мочи. Следовательно, заболевание чаще диагностируется в ситуациях, когда скрининг мочи является обязательным (например, у школьников в Японии ).
Очень редко (по 5%) анамнез:
- Нефритический синдром
- Острая почечная недостаточность (либо как осложнение явной гематурии, когда она обычно восстанавливается, либо из-за быстро прогрессирующего гломерулонефрита, который часто приводит к хронической почечной недостаточности )
- Хроническая почечная недостаточность (без предыдущих симптомов, проявляется анемией , гипертонией и другими симптомами почечной недостаточности у людей, у которых, вероятно, была длительная необнаруженная микроскопическая гематурия и / или протеинурия)
С агрессивной IgA-нефропатией (болезнью Бергера) связаны различные системные заболевания, такие как печеночная недостаточность , рак , целиакия , системная красная волчанка , ревматоидный артрит , сердечная недостаточность , реактивный артрит , анкилозирующий спондилит и ВИЧ . Диагностика болезни Бергера и поиск любого связанного с ней заболевания иногда выявляют такое основное серьезное системное заболевание. Иногда появляются одновременные симптомы пурпуры Геноха – Шенлейна ; см. ниже более подробную информацию об ассоциации. Некоторые аллели HLA, наряду с фенотипами комплемента, предположительно являются генетическими факторами. Неагрессивная болезнь Бергера также может быть связана с любым из перечисленных выше системных заболеваний, однако это бывает редко.
Морфология
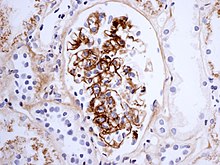
Гистологически IgA-нефропатия может показывать мезангиальное расширение и очаговое и сегментарное воспаление. Также может присутствовать диффузная мезангиальная пролиферация или серповидный гломерулонефрит. Иммунофлуоресценция показывает мезангиальное отложение IgA, часто с C3 и пропердином и меньшими количествами других иммуноглобулинов ( IgG или IgM ). Ранние компоненты классического пути комплемента ( C1q или C4 ) обычно не видны. Электронная микроскопия подтверждает электронно-плотные отложения в мезангиуме, которые могут распространяться на субэндотелиальную область прилегающих стенок капилляров в небольшом подмножестве случаев, обычно с очаговой пролиферацией.
Патофизиология
The disease derives its name from deposits of immunoglobulin A (IgA) in a granular pattern in the mesangium (by immunofluorescence), a region of the renal glomerulus. The mesangium by light microscopy may be hypercellular and show increased deposition of extracellular matrix proteins. In terms of the renal manifestation of Henoch–Schönlein purpura, it has been found that although it shares the same histological spectrum as IgA nephropathy, a greater frequency of severe lesions such as glomerular necrosis and crescents were observed. Correspondingly, HSP nephritis has a higher frequency of glomerular staining for fibrin compared with IgAN, but with an otherwise similar immunofluorescence profile.
Нет четкого известного объяснения накопления IgA. Экзогенные антигены IgA не были идентифицированы в почках, но возможно, что этот антиген был выведен до того, как болезнь проявит себя. Также было высказано предположение, что сам IgA может быть антигеном.
Недавно выдвинутая теория фокусируется на аномалиях молекулы IgA1. IgA1 - это один из двух подклассов иммуноглобулинов (другой - IgD), который O-гликозилирован по ряду остатков серина и треонина в специальной богатой пролином шарнирной области. Аберрантное гликозилирование IgA, по-видимому, приводит к полимеризации молекул IgA в тканях, особенно в мезангиуме клубочков. Утверждается, что аналогичный механизм лежит в основе пурпуры Геноха-Шенлейна , васкулита, который в основном поражает детей и может иметь поражение почек, почти неотличимое от IgA-нефрита. Однако исследования на людях показали, что дегалактозилирование IgA1 происходит у пациентов с нефропатией IgA в ответ только на воздействие антигена кишечника (не системное) и в меньшей степени встречается у здоровых людей. Это убедительно свидетельствует о том, что дегалактозилирование IgA1 является результатом лежащего в основе явления (аномального взаимодействия с антигеном слизистой оболочки), а не основной причиной нефропатии IgA. Имеющиеся данные свидетельствуют о том, что для образования комплексов иммуноглобулина и их накопления в клубочках необходимы как о-гликаны с дефицитом галактозы в шарнирной области IgA1, так и синтез и связывание антител против IgA1.
Из того факта, что IgAN может рецидивировать после трансплантации почки, можно предположить, что заболевание вызвано проблемой в иммунной системе, а не самой почкой. Примечательно, что IgA1, который накапливается в почках, по-видимому, происходит не из лимфоидной ткани, связанной со слизистой оболочкой (MALT), которая является местом большинства инфекций верхних дыхательных путей, а из костного мозга . Это тоже указывает на иммунную патологию, а не на прямое вмешательство внешних агентов.
Естественная история
Поскольку IgA-нефропатия обычно проявляется бессимптомно из-за отклонений от нормы в анализе мочи , существует значительная вероятность различий в любой изучаемой популяции в зависимости от политики скрининга . Точно так же решающую роль играет местная политика проведения биопсии почки ; если это политика простого наблюдения за пациентами с изолированной кровянистой мочой , группа с в целом благоприятным прогнозом будет исключена. Если, напротив, у всех таких пациентов будет проведена биопсия, тогда будет включена группа с изолированной микроскопической гематурией и изолированным мезангиальным IgA, что улучшит прогноз для этой конкретной серии.
Тем не менее, IgA-нефропатия, которая изначально считалась доброкачественным заболеванием, не является доброкачественным заболеванием, особенно если у пациента имеется агрессивная форма. Хотя в большинстве отчетов болезнь Бергера описывается как медленная эволюция в сторону заживления или повреждения почек, иногда наблюдается более агрессивное течение, связанное с обширными серповидными лучами и проявляющееся как острая почечная недостаточность . В общем, переход в хроническую почечную недостаточность происходит медленно по сравнению с большинством других гломерулонефритов - в течение 30 лет и более (в отличие от 5-15 лет для других гломерулонефритов), однако при агрессивной болезни Бергера время шкала находится в пределах 5–10 лет, а часто и раньше. Это может отражать ранее поставленный диагноз из-за явной гематурии.
Полная ремиссия агрессивной болезни Бергера, редко встречается у взрослых. Однако примерно в 5% случаев вероятность ремиссии выше при неагрессивной болезни Бергера (по оценкам, это составляет около 7,4% случаев). Высокий шанс рецидива, особенно при агрессивной болезни Бергера. Однако, учитывая развитие этого заболевания, более долгосрочный (10–20 лет) исход для таких пациентов еще не установлен.
В целом, текущая 10-летняя выживаемость при агрессивной болезни Бергера составляет 25% и 73% при неагрессивной болезни Бергера.
Диагностика
Взрослому пациенту с изолированной гематурией обычно сначала проводят такие тесты, как УЗИ почек и цистоскопию , чтобы точно определить источник кровотечения . Эти тесты позволили бы исключить камни в почках и рак мочевого пузыря , две другие распространенные урологические причины гематурии. У детей и молодых людей история болезни и связь с респираторной инфекцией могут вызвать подозрение на IgA-нефропатию. Для подтверждения диагноза необходима биопсия почки . Образец биопсии показывает разрастание мезангиума с отложениями IgA при иммунофлуоресценции и электронной микроскопии . Однако пациентам с изолированной микроскопической гематурией (т.е. без сопутствующей протеинурии и с нормальной функцией почек ) биопсия обычно не проводится, поскольку это связано с отличным прогнозом . Анализ мочи покажет эритроциты , обычно в виде цилиндров из мочи . Также может присутствовать протеинурия , обычно менее 2 граммов в день. Другие почечные причины изолированной гематурии включают болезнь тонкой базальной мембраны и синдром Альпорта , последний является наследственным заболеванием, связанным с нарушением слуха и проблемами зрения.
Другие анализы крови, проводимые для диагностики, включают СРБ или СОЭ , уровни комплемента , АНА и ЛДГ . Электрофорез белков и уровни иммуноглобулинов могут показать повышенный уровень IgA у 50% всех пациентов.
Уход
Идеальное лечение IgAN должно удалить IgA из клубочков и предотвратить дальнейшее отложение IgA. Эта цель все еще остается отдаленной перспективой. Есть несколько дополнительных предостережений, которые необходимо учитывать при лечении IgA-нефропатии. IgA-нефропатия имеет очень вариабельное течение, от доброкачественной рецидивирующей гематурии до быстрого прогрессирования до хронической почечной недостаточности и отказа других основных органов. Следовательно, решение о том, каких пациентов лечить, должно основываться на прогностических факторах и риске прогрессирования. Кроме того, IgA-нефропатия рецидивирует при трансплантации, несмотря на применение у этих пациентов циклоспорина , азатиоприна или микофенолятмофетила , циклофосфамида , изотретиноина и стероидов . Сохраняются неопределенности из-за ограниченного числа пациентов, включенных в немногочисленные контролируемые рандомизированные исследования, проведенные на сегодняшний день. Эти исследования практически не дают статистически значимых доказательств гетерогенности пациентов с IgA-нефропатией, разнообразия протоколов исследуемого лечения и продолжительности последующего наблюдения.
В случаях, когда тонзиллит является провоцирующим фактором эпизодической гематурии, утверждается , что тонзиллэктомия снижает частоту этих эпизодов. Однако это не снижает частоту прогрессирующей почечной недостаточности . Ограничение диетического глютена , используемое для уменьшения заражения слизистыми оболочками антигеном , также не показало, что сохраняет функцию почек . Фенитоин также был испытан без всякой пользы.
Подгруппа пациентов с IgA-нефропатией, которые имеют болезнь минимальных изменений при световой микроскопии и клинически имеют нефротический синдром , демонстрируют прекрасный ответ на стероиды , ведя себя более или менее как болезнь минимальных изменений . У других пациентов доказательства применения стероидов неубедительны. Доказано, что короткие курсы стероидов в высоких дозах не приносят пользы. Однако у пациентов с агрессивной болезнью Бергера 6-месячный курс стероидов в дополнение к другим лекарствам может уменьшить протеинурию и сохранить функцию почек. В исследовании использовались данные последующего наблюдения за пациентами в течение 10 лет, и оно показало пользу от стероидной терапии; в группе стероидов была более низкая вероятность достижения терминальной стадии почечной недостаточности (функция почек настолько плохая, что требовался диализ). Важно отметить, что ингибиторы ангиотензинпревращающего фермента использовались в обеих группах одинаково.
Циклофосфамид (продаются как эндоксан и Cytoxan ) и изотретиноины были широко используется, часто с анти-тромбоциты / антикоагулянтами у больных с болезнью АГРЕССИВНОГО Бергера, однако, профиль побочного эффекта этих препаратов, в том числе долгосрочного риска злокачественных новообразований и стерильности , сделал их неблагоприятный выбор для использования у молодых людей. Однако одно недавнее исследование, проведенное на тщательно отобранной популяции пациентов с высоким риском и снижающейся СКФ , показало, что комбинация стероидов и циклофосфамида в течение первых 3 месяцев с последующим приемом азатиоприна в течение минимум 2 лет приводила к значительному сохранению функции почек. Другие агенты, такие как микофенолятмофетил , циклоспорин и мизорибин , также были опробованы с разными результатами.
Исследование Mayo Clinic показало, что длительное лечение омега-3 жирными кислотами приводит к небольшому снижению прогрессирования почечной недостаточности , однако без снижения протеинурии у части пациентов с высоким риском ухудшения функции почек . Однако эти результаты не были воспроизведены другими исследовательскими группами и в двух последующих метаанализах. Однако у терапии рыбьим жиром нет недостатков иммуносупрессивной терапии . Кроме того, помимо неприятного вкуса и дискомфорта в животе, его употреблять относительно безопасно.
События, которые имеют тенденцию к прогрессирующей почечной недостаточности, не являются уникальными для IgA-нефропатии, и неспецифические меры по их снижению были бы одинаково полезны. К ним относятся диета с низким содержанием белка и оптимальный контроль артериального давления . Выбор гипотензивного средства открыт до тех пор, пока артериальное давление поддерживается на желаемом уровне. Однако ингибиторы ангиотензинпревращающего фермента и антагонисты рецептора ангиотензина II являются предпочтительными из-за их антипротеинурического эффекта.
Прогноз
Мужской пол, протеинурия (особенно> 2 г / день), гипертония , курение , гиперлипидемия , пожилой возраст, семейные заболевания и повышенная концентрация креатинина являются маркерами неблагоприятного исхода. Откровенная гематурия показала противоречивые результаты, причем большинство исследований показало лучший прогноз, возможно, связанный с ранним диагнозом, за исключением одной группы, которая сообщила о более плохом прогнозе. Протеинурия и гипертония - самые сильные прогностические факторы в этой группе.
При биопсии почки есть некоторые другие особенности, такие как интерстициальное рубцевание, которые связаны с плохим прогнозом. Недавно было показано, что полиморфизм гена ACE влияет на генотип DD, который чаще ассоциируется с прогрессированием почечной недостаточности .
Эпидемиология
Мужчины болеют в три раза чаще, чем женщины. Также существуют заметные географические различия в распространенности IgA-нефропатии во всем мире. Это наиболее распространенное заболевание клубочков на Дальнем Востоке и в Юго-Восточной Азии , на которое приходится почти половина всех пациентов с заболеванием клубочков. Однако на его долю приходится только около 25% доли среди европейцев и около 10% среди североамериканцев, причем афроамериканцы имеют очень низкий показатель распространенности - около 2%. Смешивающим фактором в этом анализе является существующая политика скрининга и использования биопсии почки в качестве инструмента исследования. Школьники в Японии проходят рутинный анализ мочи (как и призывники в армии в Сингапуре ), а любые подозрительные отклонения от нормы выявляются с помощью биопсии почек, что частично может объяснить высокую наблюдаемую в этих странах заболеваемость IgA-нефропатией.
Генетика
Несмотря на то, что были описаны различные ассоциации, на сегодняшний день не выявлено последовательной закономерности, указывающей на единственный чувствительный ген. Описанные ассоциации включают ассоциации с нулевым аллелем C4, аллелями фактора B Bf, антигенами MHC и изотипами IgA. Полиморфизм гена АПФ (аллель D) связан с прогрессированием почечной недостаточности, как и его связь с другими причинами хронической почечной недостаточности . Однако более 90% случаев нефропатии IgA носят спорадический характер, при этом описано несколько крупных родословных из Кентукки и Италии ( Online Mendelian Inheritance in Man (OMIM): 161950 ).
История
Уильям Хеберден -старший впервые описал болезнь в 1801 году у 5-летнего ребенка с болями в животе, гематурией , гематохезией и пурпурой ног. В 1837 году Иоганн Лукас Шенлейн описал синдром пурпуры, связанный с болью в суставах и выделениями в моче у детей. Эдуард Генрих Генох , ученик Шенлейна, также связал с синдромом боль в животе и поражение почек.
В 1968 году Жан Бергер (1930–2011), французский нефролог-новатор , в соавторстве с электронным микроскопом Николь Хинглэйс впервые описал отложение IgA при этой форме гломерулонефрита, поэтому ее иногда называют болезнью Бергера.
использованная литература
внешние ссылки
| Классификация | |
|---|---|
| Внешние ресурсы |