Иксазомиб - Ixazomib
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Ninlaro |
| Другие названия | MLN2238 |
| AHFS / Drugs.com | Монография |
| MedlinePlus | a616008 |
| Данные лицензии | |
Категория беременности |
|
| Пути администрирования |
Внутрь ( капсулы ) |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетические данные | |
| Биодоступность | 58% |
| Связывание с белками | 99% |
| Метаболизм | Печеночные ( CYP : 3A4 (42%), 1A2 (26%), 2B6 (16%) и другие) |
| Ликвидация Период полураспада | 9,5 дней |
| Экскреция | Моча (62%), фекалии (22%) |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ECHA InfoCard |
100.238.319 |
| Химические и физические данные | |
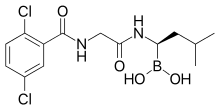
| Формула | C 14 H 19 B Cl 2 N 2 O 4 |
| Молярная масса | 361,03 г · моль -1 |
| 3D модель ( JSmol ) | |
| |
| |
Иксазомиб (торговое название Ninlaro ) - это лекарство для лечения множественной миеломы , типа рака лейкоцитов , в сочетании с другими лекарствами. Принимается внутрь в виде капсул.
Общие побочные эффекты включают диарею, запор и низкое количество тромбоцитов . Как и более старый бортезомиб (который можно вводить только в виде инъекций), он действует как ингибитор протеасом , имеет статус орфанного препарата в США и Европе и является производным бороновой кислоты .
Препарат был разработан компанией Takeda . В США он утвержден с ноября 2015 года, а в ЕС - с ноября 2016 года.
Медицинское использование
Иксазомиб используется в сочетании с леналидомидом и дексаметазоном для лечения множественной миеломы у взрослых, по крайней мере, после одной предшествующей терапии. Нет опыта работы с детьми и подростками до 18 лет.
В актуальное для утверждения исследование включены 722 человека. В этом исследовании иксазомиб увеличивал среднее время выживания без прогрессирования заболевания с 14,7 месяцев (в группе плацебо + леналидомид + дексаметазон, включая 362 человека) до 20,6 месяцев (в группе иксазомиб + леналидомид + дексаметазон, 360 человек), что было статистически значимым значительный эффект ( р = 0,012). У 11,7% пациентов в группе иксазомиба был полный ответ на лечение по сравнению с 6,6% в группе плацебо. Общий процент ответов (полный плюс частичный) составил 78,3% против 71,5%.
Исследование фазы 3 продемонстрировало значительное улучшение выживаемости без прогрессирования заболевания (ВБП) при приеме иксазомиб-леналидомид-дексаметазон (IRd) по сравнению с плацебо. Цитогенетические аномалии высокого риска определялись как del (17p), t (4; 14) и / или t (14; 16); Кроме того, пациентов оценивали на предмет амплификации 1q21. Из 722 рандомизированных пациентов у 552 были цитогенетические результаты; 137 (25%) имели цитогенетические аномалии высокого риска, а 172 (32%) имели только амплификацию 1q21. ВБП была улучшена с помощью IRd по сравнению с плацебо в цитогенетических подгруппах как высокого, так и стандартного риска: у пациентов высокого риска, со средней ВБП 21,4 против 9,7 месяцев; у пациентов стандартного риска со средней выживаемостью без плода 20,6 против 15,6 месяцев. Это преимущество ВБП было постоянным во всех подгруппах с отдельными цитогенетическими аномалиями высокого риска, включая пациентов с del (17p). ВБП также была дольше при IRd по сравнению с плацебо у пациентов с амплификацией 1q21 и в группе «расширенного высокого риска», определяемой как пациенты с цитогенетическими аномалиями высокого риска и / или амплификацией 1q21. IRd продемонстрировал существенное преимущество по сравнению с плацебо у пациентов с рецидивирующей / рефрактерной множественной миеломой с цитогенетикой высокого и стандартного риска и улучшает низкую ВБП, связанную с цитогенетическими аномалиями высокого риска.
Беременность и кормление грудью
В исследованиях на животных иксазомиб и леналидомид обладают тератогенным действием . Последний противопоказан беременным женщинам, что делает этот режим терапии неподходящим для этой группы. Неизвестно, проникает ли иксазомиб или его метаболиты в грудное молоко.
Побочные эффекты
Общие побочные эффекты исследуемой терапии иксазомиб + леналидомид + дексаметазон включали диарею (42% против 36% в группе плацебо + леналидомид + дексаметазон), запор (34% против 25%), тромбоцитопению (низкое количество тромбоцитов ; 28% против 14%), периферическая нейропатия (28% против 21%), тошнота (26% против 21%), периферический отек (отек; 25% против 18%), рвота (22% против 11%) и боль в спине (21% против 16%) . Серьезная диарея или тромбоцитопения наблюдались у 2% пациентов соответственно.
Побочные эффекты одного иксазомиба были оценены только у небольшого числа людей. Диарея 2 степени или выше была обнаружена у 24% этих пациентов, тромбоцитопения 3 степени или выше - у 28%, а степень утомляемости 2 или выше - у 26%.
Взаимодействия
Препарат имеет низкий потенциал взаимодействия через ферменты печени цитохрома P450 (CYP) и белки-переносчики . Единственным значимым открытием в исследованиях было снижение уровня иксазомиба в крови в сочетании с сильным индуктором CYP3A4 рифампицином . В этом исследовании C max была уменьшена на 54%, а площадь под кривой - на 74%.
Фармакология
Механизм действия
В терапевтических концентрациях иксазомиб избирательно и обратимо ингибирует протеасомную субъединицу бета-типа 5 (PSMB5) с периодом полужизни диссоциации 18 минут. Этот механизм тот же, что и у бортезомиба , у которого период полураспада диссоциации намного больше - 110 минут; родственный препарат карфилзомиб , напротив, необратимо блокирует PSMB5. Субъединицы протеасомы бета-типа-1 и типа-2 ингибируются только при высоких концентрациях, достигаемых в моделях клеточных культур.
PSMB5 является частью протеасомного комплекса 20S и обладает ферментативной активностью, аналогичной химотрипсину . Он вызывает апоптоз , тип запрограммированной гибели клеток в различных линиях раковых клеток. Синергетический эффект иксазомиба и леналидомида был обнаружен в большом количестве клеточных линий миеломы.
Фармакокинетика
Лекарство принимают внутрь в виде пролекарства цитрат иксазомиба, который представляет собой эфир бороновой кислоты ; этот сложный эфир быстро гидролизуется в физиологических условиях до своей биологически активной формы, иксазомиба, бороновой кислоты. Абсолютная биодоступность составляет 58%, а максимальная концентрация иксазомиба в плазме крови достигается через час. Связывание с белками плазмы составляет 99%.
Вещество метаболизируется многими ферментами CYP (процентное содержание in vitro в концентрациях выше клинических: CYP3A4 42,3%, CYP1A2 26,1%, CYP2B6 16,0%, CYP2C8 6,0%, CYP2D6 4,8%, CYP2C9 4,8%, CYP2C9 <1%). как ферменты, не относящиеся к CYP, что может объяснить низкий потенциал взаимодействия. Клиренс составляет около 1,86 литра в час с широкой вариабельностью в 44% между людьми, а период полувыведения из плазмы составляет 9,5 дней. 62% иксазомиба и его метаболитов выводятся с мочой (из которых менее 3,5% в неизмененном виде) и 22% с фекалиями.
Химия
Иксазомиб - это бороновая кислота и аналог пептида, как и более старый бортезомиб. Он содержит производное аминокислоты лейцина с замещенной группой карбоновой кислоты бороновой кислотой; а остальную часть молекулы сравнивают с фенилаланином . Структура была обнаружена путем крупномасштабного скрининга борсодержащих молекул.
История
Препарат был разработан компанией Takeda. В 2011 году он получил статус орфанного препарата в США и Европе от множественной миеломы, а в 2012 году - от амилоидоза AL . В июле 2015 года компания Takeda подала в США новую заявку на лекарство от множественной миеломы. В сентябре 2015 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) предоставило иксазомиб в сочетании с леналидомидом и дексаметазоном - приоритетная оценка при множественной миеломе. 20 ноября 2015 года FDA одобрило эту комбинацию для лечения второй линии.
Запрос на регистрацию в Европе был первоначально отклонен Европейским агентством по лекарственным средствам (EMA) в мае 2016 года из-за недостаточности данных, свидетельствующих о пользе лечения. После того, как Такеда запросил повторную экспертизу, 21 ноября 2016 года EMA предоставило разрешение на продажу при условии, что будут проведены дальнейшие исследования эффективности. Обозначение утверждения такое же, как в США.
Исследование
По состоянию на январь 2017 года иксазомиб также находится в фазе III клинических испытаний для лечения амилоидоза AL и плазмоцитомы костей, а также в фазе I / II испытаний для различных других состояний.
Рекомендации
внешние ссылки
- «Иксазомиб» . Информационный портал о наркотиках . Национальная медицинская библиотека США.
- «Цитрат иксазомиба» . Информационный портал о наркотиках . Национальная медицинская библиотека США.

