Микродиализ - Microdialysis
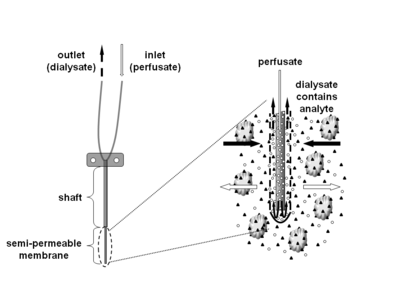
Микродиализ - это минимально инвазивный метод отбора проб, который используется для непрерывного измерения концентрации свободных, несвязанных аналитов во внеклеточной жидкости практически любой ткани. Аналиты могут включать эндогенные молекулы (например, нейромедиатор , гормоны , глюкозу и т.д.) для оценки их биохимических функций в организме или экзогенные соединения (например, фармацевтические препараты ) для определения их распределения в организме. Техника микродиализа требует введения небольшого катетера микродиализа (также называемого зондом микродиализа) в интересующую ткань. Зонд для микродиализа имитирует кровеносный капилляр и состоит из стержня с полупроницаемой половолоконной мембраной на конце, который соединен с впускной и выпускной трубками. Зонд непрерывно перфузируется водным раствором (перфузатом), который очень напоминает (ионный) состав окружающей тканевой жидкости при низкой скорости потока примерно 0,1-5 мкл / мин. Попав в интересующую ткань или (тело) жидкость, небольшие растворенные вещества могут проникать через полупроницаемую мембрану за счет пассивной диффузии . Направление потока аналита определяется соответствующим градиентом концентрации и позволяет использовать зонды микродиализа в качестве инструментов для отбора проб и доставки. Раствор, покидающий зонд (диализат), собирается через определенные промежутки времени для анализа.
История
Принцип микродиализа был впервые использован в начале 1960-х годов, когда двухтактные канюли и диализные мешки были имплантированы в ткани животных, особенно в мозг грызунов, для непосредственного изучения биохимии тканей. Хотя эти методы имели ряд экспериментальных недостатков, таких как количество образцов на животное или отсутствие / ограниченное временное разрешение, изобретение дилитродов с непрерывной перфузией в 1972 году помогло преодолеть некоторые из этих ограничений. Дальнейшее усовершенствование концепции дилитрода привело к изобретению в 1974 году «полого волокна», трубчатой полупроницаемой мембраны диаметром ~ 200-300 мкм. Наиболее распространенная на сегодняшний день форма, игольчатый зонд, состоит из стержня с полым волокном. на кончике и может быть введен с помощью направляющей канюли в мозг и другие ткани. Альтернативный метод, микроперфузия с открытым потоком (OFM), заменяет мембрану макроскопическими отверстиями, что облегчает отбор образцов липофильных и гидрофильных соединений, связанных и несвязанных с белками лекарств, нейротрансмиттеров , пептидов и белков , антител , наночастиц и наноносителей , ферментов и везикул .
Зонды для микродиализа
Доступно множество зондов с различными комбинациями длины мембраны и стержня. Предельное значение молекулярной массы коммерчески доступных зондов для микродиализа охватывает широкий диапазон приблизительно от 6 до 100 кДа, но также доступен 1MD. В то время как водорастворимые соединения обычно свободно диффундируют через мембрану микродиализа, ситуация не так ясна для высоколипофильных аналитов, о которых сообщалось как об успешных (например, кортикостероиды), так и неудачных экспериментах по микродиализу (например, эстрадиол, фузидовая кислота). Однако извлечение водорастворимых соединений обычно быстро снижается, если молекулярная масса анализируемого вещества превышает 25% предельной молекулярной массы мембраны.
Методы восстановления и калибровки
Из-за постоянной перфузии микродиализного зонда свежим перфузатом невозможно установить полное равновесие. Это приводит к тому, что концентрации диализата ниже, чем измеренные на удаленном участке отбора проб. Чтобы сопоставить концентрации, измеренные в диализате, с концентрациями, присутствующими в удаленном месте отбора проб, необходим калибровочный коэффициент (восстановление). Извлечение можно определить в установившемся режиме, используя постоянную скорость обмена аналита через мембрану микродиализа. Скорость, с которой аналит обменивается через полупроницаемую мембрану, обычно выражается как эффективность извлечения аналита. Эффективность экстракции определяется как отношение между потерей / приростом аналита во время его прохождения через зонд (C in -C out ) и разницей в концентрации между перфузатом и удаленным местом отбора проб (C in -C образец ).
Теоретически эффективность экстракции микродиализного зонда может быть определена: 1) изменением концентраций лекарственного средства при сохранении постоянной скорости потока или 2) изменением скорости потока при сохранении постоянных соответствующих концентраций лекарственного средства. В стационарном режиме достигается одно и то же значение эффективности экстракции, независимо от того, обогащен ли аналит перфузатом или истощен. Следовательно, зонды для микродиализа могут быть откалиброваны либо путем измерения потери анализируемого вещества с использованием перфузата, содержащего лекарство, либо путем измерения увеличения количества анализируемого вещества с использованием растворов образцов, содержащих лекарственное средство. На сегодняшний день наиболее часто используемыми методами калибровки являются метод низкого расхода, метод отсутствия чистого потока, динамический (расширенный) метод отсутствия чистого потока и метод ретродиализа. Правильный выбор подходящего метода калибровки критически важен для успеха эксперимента по микродиализу. Поэтому рекомендуются поддерживающие эксперименты in vitro перед использованием на животных или людях. Кроме того, восстановление, определенное in vitro, может отличаться от восстановления у людей. Поэтому его фактическое значение необходимо определять в каждом эксперименте in vivo.
Метод с низким расходом
Метод низкого расхода основан на том факте, что эффективность экстракции зависит от расхода. При высоких скоростях потока количество лекарства, диффундирующего из места отбора пробы в диализат за единицу времени, меньше (низкая эффективность экстракции), чем при более низких скоростях потока (высокая эффективность экстракции). При нулевом расходе устанавливается полное равновесие между этими двумя участками (C out = C sample ). Эта концепция применяется для метода (низкой) скорости потока, когда зонд перфузируется холостым перфузатом с разной скоростью потока. Концентрация в месте отбора проб может быть определена путем построения графиков соотношений экстракции в зависимости от соответствующих скоростей потока и экстраполяции на нулевой поток. Метод с низким расходом ограничен тем фактом, что время калибровки может занять довольно много времени, прежде чем будет собран достаточный объем пробы.
Метод без чистых потоков
Во время калибровки методом no-net-flux-зонд для микродиализа перфузируется по крайней мере четырьмя различными концентрациями представляющего интерес аналита (C in ), а установившиеся концентрации аналита, выходящего из зонда, измеряются в диализате (C из ). Восстановление для этого метода может быть определено путем нанесения C out -C in на C in и вычисления наклона линии регрессии. Если концентрации анализируемого вещества в перфузате равны концентрациям в месте отбора пробы, происходит отсутствие чистого потока. Соответствующие концентрации в точке отсутствия чистого потока представлены отрезком x линии регрессии. Сила этого метода состоит в том, что в установившемся режиме не нужно делать никаких предположений о поведении соединения в непосредственной близости от зонда, поскольку равновесие существует в определенное время и в определенном месте. Однако в переходных условиях (например, после провокации лекарством) восстановление зонда может измениться, что приведет к смещению оценок концентраций в месте отбора проб. Чтобы преодолеть это ограничение, было разработано несколько подходов, которые также применимы в нестационарных условиях. Одним из таких подходов является метод динамического отсутствия чистых потоков.
Метод динамического отсутствия чистого потока
В то время как один субъект / животное перфузируются несколькими концентрациями во время метода без чистого потока, несколько субъектов перфузируются с одной концентрацией во время метода динамического отсутствия потока (DNNF). Затем данные от разных субъектов / животных объединяются в каждый момент времени для регрессионного анализа, позволяющего определить выздоровление с течением времени. Дизайн метода калибровки DNNF оказался очень полезным для исследований, которые оценивают реакцию эндогенных соединений, таких как нейротрансмиттеры, на лекарственную нагрузку.
Ретродиализ
Во время ретродиализа зонд для микродиализа перфузируется раствором, содержащим аналит, и отслеживается исчезновение лекарства из зонда. Восстановление для этого метода может быть вычислено как соотношение лекарства, потерянного во время прохождения (C in -C out ), и лекарства, поступающего в зонд для микродиализа (C in ). В принципе, ретродиализ можно проводить с использованием либо самого анализируемого вещества (ретродиализ с помощью лекарственного средства), либо эталонного соединения (ретродиализ с помощью калибратора), которое по своим физико-химическим и биологическим свойствам очень близко к аналиту. Несмотря на то, что ретродиализ с помощью лекарств нельзя использовать для эндогенных соединений, поскольку он требует отсутствия аналита в месте отбора пробы, этот метод калибровки чаще всего используется для экзогенных соединений в клинических условиях.
Приложения
Метод микродиализа претерпел большое развитие с момента его первого использования в 1972 году, когда он впервые был применен для мониторинга концентраций эндогенных биомолекул в головном мозге. Сегодняшняя область применения расширилась до мониторинга свободных концентраций как эндогенных, так и экзогенных соединений практически в любой ткани. Хотя микродиализ по-прежнему в основном используется в доклинических исследованиях на животных (например, на лабораторных грызунах, собаках, овцах, свиньях), в настоящее время он все чаще применяется у людей для мониторинга концентраций свободных, несвязанных лекарственных средств в тканях, а также межуточных концентраций регуляторных цитокинов и метаболитов в ответ на воздействие. нарушения гомеостаза, такие как кормление и / или упражнения.
При исследовании мозга микродиализ обычно используется для измерения нейромедиаторов (например, дофамина , серотонина , норэпинефрина , ацетилхолина , глутамата , ГАМК ) и их метаболитов, а также малых нейромодуляторов (например, цАМФ , цГМФ , NO ), аминокислот (например, глицина). , цистеин , тирозин ) и энергетические субстраты (например, глюкоза , лактат , пируват ). Экзогенные препараты, подлежащие анализу с помощью микродиализа, включают новые антидепрессанты , нейролептики , а также антибиотики и многие другие препараты, фармакологическое действие которых находится в головном мозге. Первым неметаболитом, который был проанализирован с помощью микродиализа in vivo в головном мозге человека, был рифампицин .
Применения в других органах включают кожу (оценка биодоступности и биоэквивалентности дерматологических лекарственных препаратов местного применения) и мониторинг концентрации глюкозы у пациентов с диабетом (внутрисосудистое или подкожное размещение зонда). Последний может даже быть включен в систему искусственной поджелудочной железы для автоматического введения инсулина.
Микродиализ также нашел все более широкое применение в исследованиях окружающей среды, при отборе проб различных соединений из сточных вод и почвенного раствора, включая сахариды, ионы металлов, микроэлементы, органические кислоты и низкомолекулярный азот. Учитывая разрушительный характер традиционных методов отбора проб почвы, микродиализ может оценить потоки почвенных ионов, которые лучше отражают ненарушенную почвенную среду.
Критический анализ
Преимущества
- На сегодняшний день микродиализ является единственным методом отбора проб in vivo , который позволяет непрерывно контролировать концентрацию лекарств или метаболитов во внеклеточной жидкости практически любой ткани. В зависимости от конкретного применения, концентрацию аналита можно контролировать в течение нескольких часов, дней или даже недель. Концентрации свободных, несвязанных внеклеточных тканей во многих случаях представляют особый интерес, поскольку они напоминают фармакологически активные концентрации в месте действия или вблизи него. Комбинация микродиализа с современными методами визуализации, такими как позитронно-эмиссионная томография , также позволяет определять внутриклеточные концентрации.
- Введение зонда в точное место выбранной ткани дополнительно позволяет оценить градиенты внеклеточной концентрации, обусловленные активностью переносчика или другими факторами, такими как различия в перфузии. Поэтому он был предложен как наиболее подходящий метод для исследования распределения в тканях.
- Обмен аналита через полупроницаемую мембрану и постоянная замена жидкости для отбора проб свежим перфузатом предотвращает дренаж жидкости из места отбора проб, что позволяет проводить отбор без потери жидкости. Следовательно, микродиализ можно использовать без нарушения условий тканей из-за локальной потери жидкости или артефактов давления, которые могут возникать при использовании других методов, таких как микроинъекция или двухтактная перфузия.
- Полупроницаемая мембрана предотвращает попадание клеток, клеточного мусора и белков в диализат. Из-за недостатка белка в диализате очистка образца перед анализом не требуется, и ферментативное разложение не вызывает беспокойства.
Ограничения
- Несмотря на научные достижения в уменьшении размеров и более эффективных зондов для микродиализа, инвазивный характер этого метода по-прежнему создает некоторые практические и этические ограничения. Например, было показано, что имплантация зонда для микродиализа может изменить морфологию ткани, что приведет к нарушению микроциркуляции, скорости метаболизма или целостности физиологических барьеров, таких как гематоэнцефалический барьер . В то время как острые реакции на введение зонда, такие как травмы имплантации, требуют достаточного времени для восстановления, дополнительные факторы, такие как некроз , воспалительные реакции или процессы заживления ран, должны быть приняты во внимание для долгосрочного отбора проб, поскольку они могут повлиять на результат эксперимента. С практической точки зрения было предложено проводить эксперименты по микродиализу в оптимальном временном окне, обычно через 24–48 часов после введения зонда.
- Микродиализ имеет относительно низкое временное и пространственное разрешение по сравнению, например, с электрохимическими биосенсорами . В то время как временное разрешение определяется длиной интервалов выборки (обычно несколько минут), пространственное разрешение определяется размерами зонда. Размер зонда может варьироваться в зависимости от области применения и охватывает диапазон от нескольких миллиметров (внутримозговое введение) до нескольких сантиметров ( подкожное введение) в длину и несколько сотен микрометров в диаметре.
- Применение метода микродиализа часто ограничивается определением восстановления зонда, особенно в экспериментах in vivo . Определение выздоровления может занять много времени и может потребоваться дополнительные испытуемые или пилотные эксперименты. Восстановление во многом зависит от скорости потока: чем ниже скорость потока, тем выше выход. Однако на практике скорость потока не может быть уменьшена слишком сильно, поскольку либо объем пробы, полученный для анализа, будет недостаточным, либо временное разрешение эксперимента будет потеряно. Поэтому важно оптимизировать взаимосвязь между скоростью потока и чувствительностью аналитического анализа. Ситуация может быть более сложной для липофильных соединений, поскольку они могут прилипать к трубке или другим компонентам зонда, что приводит к низкому извлечению аналита или его отсутствию.