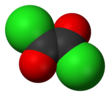
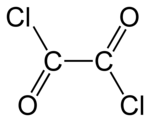
Оксалилхлорид - Oxalyl chloride
|
|||
|
|
|||

|
|||
| Имена | |||
|---|---|---|---|
|
Предпочтительное название IUPAC
Оксалил дихлорид |
|||
|
Систематическое название ИЮПАК
Этандиоил дихлорид |
|||
| Другие названия
Хлорид
щавелевой кислоты Дихлорид щавелевой кислоты Дихлорид щавелевой кислоты Оксалоилхлорид |
|||
| Идентификаторы | |||
|
3D модель ( JSmol )
|
|||
| ChemSpider | |||
| ECHA InfoCard |
100.001.092 |
||
| Номер ЕС | |||
|
PubChem CID
|
|||
| Номер RTECS | |||
| UNII | |||
|
Панель управления CompTox ( EPA )
|
|||
|
|||
|
|||
| Характеристики | |||
| С 2 О 2 Cl 2 | |||
| Молярная масса | 126,93 г / моль | ||
| Появление | Бесцветная жидкость | ||
| Плотность | 1,4785 г / мл | ||
| Температура плавления | -16 ° С (3 ° F, 257 К) | ||
| Точка кипения | От 63 до 64 ° C (от 145 до 147 ° F; от 336 до 337 K) при 1,017 бар | ||
| Реагирует | |||
|
Показатель преломления ( n D )
|
1,429 | ||
| Опасности | |||
| Основные опасности | Токсичный, едкий, слезоточивый | ||
| Паспорт безопасности | Внешний паспорт безопасности материала | ||
| Пиктограммы GHS |
 
|
||
| Сигнальное слово GHS | Опасность | ||
| H314 , H331 | |||
| P261 , P280 , P305 + 351 + 338 , P310 | |||
| NFPA 704 (огненный алмаз) | |||
| Родственные соединения | |||
|
Родственные ацилхлориды
|
Малонил хлорид сукцинил хлорида фосгена |
||
|
Родственные соединения
|
Щавелевая кислота диэтилоксалата оксамидом оксалилхлорид гидразид Cuprizon 1 |
||
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|||
|
|
|||
| Ссылки на инфобоксы | |||
Оксалилхлорид - это химическое соединение с формулой (COCl) 2 . Это бесцветное, острый пахнущие жидкости, ди - ацил хлорид из щавелевой кислоты , является полезным реагентом в органическом синтезе .
Подготовка
Оксалилхлорид был впервые получен в 1892 году французским химиком Адрианом Фоконье, который вступил в реакцию диэтилоксалата с пентахлоридом фосфора. Она также может быть получена путем обработки щавелевой кислоты с пентахлоридом фосфора .
Оксалилхлорид коммерчески производится из этиленкарбоната . Фотохлорирование дает тетрахлорид, который впоследствии разлагается:
- C 2 H 4 O 2 CO + 4 Cl 2 → C 2 Cl 4 O 2 CO + 4 HCl
- C 2 Cl 4 O 2 CO → C 2 O 2 Cl 2 + COCl 2
Реакции
Оксалилхлорид реагирует с водой с выделением только газообразных продуктов: хлористого водорода (HCl), диоксида углерода (CO 2 ) и монооксида углерода (CO).
- (COCl)
2 + H
2О → 2 HCl + CO
2 + CO
В этом он сильно отличается от других ацилхлоридов, которые гидролизуются с образованием хлористого водорода и исходной карбоновой кислоты .
Применения в органическом синтезе
Окисление спиртов
Раствор, содержащий ДМСО и оксалилхлорид, с последующим гашением триэтиламином превращает спирты в соответствующие альдегиды и кетоны посредством процесса, известного как окисление по Сверну .
Синтез ацилхлоридов
Оксалилхлорид в основном используется вместе с N , N- диметилформамидным катализатором в органическом синтезе для получения ацилхлоридов из соответствующих карбоновых кислот . Как и тионилхлорид , в этом случае реагент разлагается на летучие побочные продукты, что упрощает обработку. Одним из второстепенных побочных продуктов реакции, катализируемой N , N- диметилформамидом, является мощный канцероген, возникающий при разложении N , N- диметилформамида. По сравнению с тионилхлоридом оксалилхлорид является более мягким и селективным реагентом . Кроме того, он дороже, чем тионилхлорид, поэтому его обычно используют в меньших масштабах.
Эта реакция включает превращение ДМФ в производное имидоилхлорида (Me 2 N = CHCl + ), как и первая стадия реакции Вильсмайера – Хаака . Имидоилхлорид является активным хлорирующим агентом.
Формилирование аренов
Оксалилхлорид реагирует с ароматическими соединениями в присутствии хлорида алюминия с образованием соответствующего ацилхлорида в процессе, известном как ацилирование Фриделя-Крафтса . Полученный ацилхлорид можно гидролизовать с образованием соответствующей карбоновой кислоты .
Получение диэфиров оксалатов
Как и другие ацилхлориды, оксалилхлорид реагирует со спиртами с образованием сложных эфиров:
- 2 РЧ
2ОН + (COCl)
2 → RCH
2OC (O) C (O) OCH
2R + 2 HCl
Обычно такие реакции проводят в присутствии основания, такого как пиридин . Диэфир, полученный из фенола , фенилоксалатного эфира , представляет собой Cyalume, активный ингредиент светящихся палочек .
Другой
Сообщается, что оксалилхлорид был использован в первом синтезе диоксантетракетона (C 4 O 6 ), оксида углерода .
Меры предосторожности
В марте 2000 года самолет Airbus A330 -300 Malaysia Airlines был поврежден и не подлежал ремонту после того, как в грузовой отсек просочился груз запрещенного оксалилхлорида (ложно заявленного как гидроксихинолин). Он токсичен при вдыхании, хотя он более чем на порядок менее токсичен, чем родственный фосген.