PIM1 - PIM1
Прото-онкоген серин / треонин-протеинкиназа Pim-1 представляет собой фермент , который у человека кодируется Pim1 геном .
Pim-1 - это протоонкоген, кодирующий одноименную серин / треонинкиназу . Онкоген pim-1 был впервые описан в отношении мышиных Т-клеточных лимфом , поскольку это был локус, наиболее часто активируемый вирусом мышиного лейкоза Молони . Впоследствии онкоген был вовлечен во множество раковых заболеваний человека, включая рак простаты , острый миелоидный лейкоз и другие злокачественные гемопоэтические заболевания. В первую очередь экспрессируется в клетках селезенки, тимуса, костного мозга, предстательной железы, эпителия полости рта , гиппокампа и фетальной печени, Pim-1 также высоко экспрессируется в клеточных культурах, выделенных из опухолей человека. Pim-1 в основном участвует в развитии клеточного цикла , апоптозе и активации транскрипции , а также в более общих путях передачи сигналов. Роль Pim-1 в онкогенной передаче сигналов привела к тому, что он стал широко изучаемой целью в исследованиях рака, при этом исследуются многочисленные кандидаты в лекарственные препараты, нацеленные на него.
Ген
Расположенный на хромосоме 6 (6p21.2), ген включает 5 КБ ДНК, включая 6 экзонов и 5 интронов. Было показано, что экспрессия Pim-1 регулируется путем JAK / STAT . Прямое связывание факторов транскрипции STAT3 и STAT5 с промотором Pim-1 приводит к транскрипции Pim-1. Было обнаружено, что ген Pim-1 сохраняется у собак, коров, мышей, крыс, рыбок данио и C. elegans . Было показано, что мыши с дефицитом Pim-1 являются фенотипически нормальными, что указывает на избыточность функции этой киназы. Фактически поиск гомологии последовательностей показал, что две другие Pim-1-подобные киназы, Pim-2 и Pim-3, структурно и функционально подобны. Ген, кодируемый Pim-1, имеет несколько сайтов инициации трансляции, в результате чего образуются два белка размером 34 и 44 кДа.
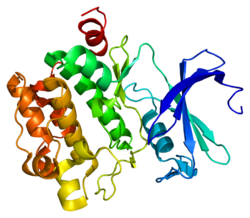
Белковая структура
Человеческий, мышиный и крысиный Pim-1 содержат 313 аминокислот и имеют 94-97% идентичности аминокислот. Активный сайт белка в диапазоне аминокислот 38-290 состоит из нескольких консервативных мотивов, включая мотив петли глицина, сайт связывания фосфата и сайт акцептора протона. Модификация белка по аминокислоте 67 (лизин на метионин) приводит к инактивации киназы.
Активация и стабилизация
Pim-1 в первую очередь участвует в передаче сигналов цитокинов и участвует во многих путях передачи сигналов. Поскольку транскрипция Pim-1 инициируется STAT3 и STAT5, его продукция регулируется цитокинами, которые регулируют путь STAT или факторы STAT. К ним относятся , среди прочего, интерлейкины (IL-2, IL-3, IL-5, IL-6, IL-7, IL12, IL-15), пролактин, TNFα , EGF и IFNγ . Сам Pim-1 может связываться с негативными регуляторами пути JAK / STAT, что приводит к возникновению петли отрицательной обратной связи.
Хотя мало что известно о посттранскрипционных модификациях Pim-1, было высказано предположение, что Hsp90 ответственен за сворачивание и стабилизацию Pim-1, хотя точный механизм еще не открыт. Кроме того, было показано, что серин / треонинфосфатаза PP2 разрушает Pim-1.
Взаимодействия
Было показано, что PIM1 взаимодействует с:
- CBX3 ,
- CDC25A ,
- Белок теплового шока 90 кДа альфа (цитозольный), член A1 ,
- NFATC1 ,
- Белок ядерного митотического аппарата 1 ,
- P21 ,
- SND1 и
- РЕЛА .
Другие известные субстраты / партнеры по связыванию Pim-1 включают белки, участвующие в регуляции транскрипции (ядерный адаптерный белок p100 , HP-1 , PAP-1 и TRAF2 / SNX6 ) и регуляцию пути JAK / STAT ( SOCS1 и SOCS3 ). Кроме того, было показано, что Pim-1 является кофактором c-Myc , фактора транскрипции, который, как полагают, регулирует 15% всех генов, и их синергизм проявляется в онкогенезе простаты.
Pim-1 способен фосфорилировать многие мишени, включая самого себя. Многие из его мишеней участвуют в регуляции клеточного цикла .
Активирует
- Cdc25C ( положительный регулятор G 1 / S): активация приводит к увеличению G 1 → S
- Cdc25C ( положительный регулятор G 2 / M): активация приводит к увеличению G 2 → M
Деактивирует
- Плохо (проапоптотический белок): дезактивация приводит к увеличению выживаемости клеток
- CKI (отрицательный регулятор G1 / S): дезактивация приводит к увеличению G 1 → S
- C-TAK1 (ингибитор Cdc25C): дезактивация приводит к увеличению G 2 → M
Клинические последствия
Pim-1 принимает непосредственное участие в регуляции развития клеточного цикла и апоптоза, а также причастен к многочисленным видам рака, включая рак простаты, лимфому Беркитта и рак ротовой полости, а также многочисленные гемопоэтические лимфомы. Однонуклеотидные полиморфизмы в гене Pim-1 были связаны с повышенным риском рака легких у корейских пациентов, а также были обнаружены в диффузных крупноклеточных лимфомах. Помимо демонстрации полезной активности против ряда видов рака, ингибиторы киназы PIM также были предложены в качестве возможных методов лечения болезни Альцгеймера . Экспрессия PIM достаточна для создания устойчивости к антиангиогенным агентам в моделях рака простаты и толстой кишки, хотя механизм полностью не выяснен. Было высказано предположение, что совместный терапевтический подход к ингибированию Pim-1 при раке может быть предпочтительным с предполагаемыми ко-целями, включая путь PI3K и многое другое.
Ингибиторы
Было разработано большое количество низкомолекулярных ингибиторов PIM1. К настоящему времени результаты клинических испытаний показали многообещающую противораковую активность, но побочные эффекты из-за недостаточной селективности оказались проблематичными, и исследования продолжаются, чтобы найти более сильные и селективные ингибиторы для этой цели.
- Примеры
использованная литература
дальнейшее чтение
- Рагусси Дж., Сенгер Дж., Мокридж И., Сансо П., Рудди С., Дадли К., Шир Д., Троусдейл Дж. (Ноябрь 1992 г.). «Ген Zn-пальца, экспрессируемый семенниками (ZNF76) в центромерном 6p21.3 человека по отношению к MHC, тесно связан с человеческим гомологом гена t-комплекса tcp-11». Геномика . 14 (3): 673–9. DOI : 10.1016 / S0888-7543 (05) 80167-3 . PMID 1427894 .
- Сарис С.Дж., Домен Дж., Бернс А. (март 1991 г.). «Онкоген pim-1 кодирует две родственные протеин-серин / треониновые киназы путем альтернативной инициации в AUG и CUG» . Журнал EMBO . 10 (3): 655–64. DOI : 10.1002 / j.1460-2075.1991.tb07994.x . PMC 452698 . PMID 1825810 .
- Ривз Р., Шпионы Г.А., Кифер М., Барр П.Дж., Power M (июнь 1990 г.). «Первичная структура предполагаемого онкогена человека пим-1». Джин . 90 (2): 303–7. DOI : 10.1016 / 0378-1119 (90) 90195-W . PMID 2205533 .
- Амсон Р., Сиго Ф., Прзедборски С., Фландрин Дж., Гивол Д., Телерман А. (ноябрь 1989 г.). «Протоонкоген человека p33pim экспрессируется во время кроветворения плода и при различных лейкозах» . Труды Национальной академии наук Соединенных Штатов Америки . 86 (22): 8857–61. DOI : 10.1073 / pnas.86.22.8857 . PMC 298389 . PMID 2682662 .
- Телерман А., Амсон Р., Закут-Хоури Р., Гивол Д. (апрель 1988 г.). «Идентификация продукта гена pim-1 человека как 33-килодальтонного цитоплазматического белка с тирозинкиназной активностью» . Молекулярная и клеточная биология . 8 (4): 1498–503. DOI : 10.1128 / mcb.8.4.1498 . PMC 363308 . PMID 2837645 .
- Микер Т.С., Нагараджан Л., ар-Рушди А., Кроче С.М. (октябрь 1987 г.). «Клонирование и характеристика человеческого гена PIM-1: предполагаемый онкоген, связанный с протеинкиназами». Журнал клеточной биохимии . 35 (2): 105–12. DOI : 10.1002 / jcb.240350204 . PMID 3429489 . S2CID 43495337 .
- Закут-Хоури Р., Хазум С., Гивол Д., Телерман А. (1987). «Последовательность кДНК и анализ генов онкогена pim человека». Джин . 54 (1): 105–11. DOI : 10.1016 / 0378-1119 (87) 90352-0 . PMID 3475233 .
- Леверсон Дж. Д., Коскинен П. Дж., Оррико ФК, Райнио Е. М., Ялканен К. Дж., Даш А. Б., Эйзенман Р. Н., Несс С. А. (октябрь 1998 г.). «Киназа Pim-1 и p100 взаимодействуют для усиления активности c-Myb» . Молекулярная клетка . 2 (4): 417–25. DOI : 10.1016 / S1097-2765 (00) 80141-0 . PMID 9809063 .
- Мотидзуки Т., Китанака С., Ногучи К., Мурамацу Т., Асаи А., Кучино Ю. (июнь 1999 г.). «Физические и функциональные взаимодействия между киназой Pim-1 и фосфатазой Cdc25A. Последствия для Pim-1-опосредованной активации пути передачи сигнала c-Myc» . Журнал биологической химии . 274 (26): 18659–66. DOI : 10.1074 / jbc.274.26.18659 . PMID 10373478 .
- Коике Н, Майта Х, Тайра Т., Арига Х, Игучи-Арига С.М. (февраль 2000 г.). «Идентификация гетерохроматинового белка 1 (HP1) как мишени фосфорилирования с помощью киназы Pim-1 и влияние фосфорилирования на функцию репрессии транскрипции HP1 (1)» . Письма FEBS . 467 (1): 17–21. DOI : 10.1016 / S0014-5793 (00) 01105-4 . PMID 10664448 . S2CID 29392124 .
- Маита Х, Харада Й, Нагакубо Д., Китаура Х, Икеда М., Тамай К., Такахаши К., Арига Х, Игучи-Арига С. М. (август 2000 г.). «PAP-1, новый целевой белок фосфорилирования киназой pim-1» . Европейский журнал биохимии . 267 (16): 5168–78. DOI : 10.1046 / j.1432-1327.2000.01585.x . PMID 10931201 .
- Мизуно К., Широгане Т., Шинохара А., Ивамацу А., Хиби М., Хирано Т. (март 2001 г.). «Регулирование Pim-1 с помощью Hsp90». Сообщения о биохимических и биофизических исследованиях . 281 (3): 663–9. DOI : 10.1006 / bbrc.2001.4405 . PMID 11237709 .
- Паркс В.Т., Фрэнк Д.Б., Хафф С., Ренфрю Хафт С., Мартин Дж., Менг Х, де Цестекер М.П., Макнелли Дж. Г., Редди А., Тейлор С. И., Робертс А. Б., Ван Т., Лехлейдер Р. Дж. (Июнь 2001 г.). «Сортировочный нексин 6, новый SNX, взаимодействует с семейством трансформирующего фактора роста бета рецепторных серин-треониновых киназ» . Журнал биологической химии . 276 (22): 19332–9. DOI : 10.1074 / jbc.M100606200 . PMID 11279102 .
- Ван З., Бхаттачарья Н., Мейер М.К., Сеймия Х., Цуруо Т., Тонани Д.А., Магнусон Н.С. (июнь 2001 г.). «Pim-1 отрицательно регулирует активность фосфатазы PTP-U2S и влияет на терминальную дифференцировку и апоптоз клеток монобластоидного лейкоза». Архивы биохимии и биофизики . 390 (1): 9–18. DOI : 10,1006 / abbi.2001.2370 . PMID 11368509 .
- Паскуалуччи Л., Ноймейстер П., Гуссенс Т., Нанджангуд Дж., Чаганти Р.С., Кюпперс Р., Далла-Фавера Р. (июль 2001 г.). «Гипермутация множества протоонкогенов в B-клеточных диффузных крупноклеточных лимфомах». Природа . 412 (6844): 341–6. DOI : 10.1038 / 35085588 . PMID 11460166 . S2CID 4373198 .
- Ishibashi Y, Maita H, Yano M, Koike N, Tamai K, Ariga H, Iguchi-Ariga SM (сентябрь 2001 г.). «Pim-1 перемещает сортирующий нексин 6 / TRAF4-ассоциированный фактор 2 из цитоплазмы в ядро» . Письма FEBS . 506 (1): 33–8. DOI : 10.1016 / S0014-5793 (01) 02881-2 . PMID 11591366 . S2CID 40248629 .
- Райнио Э.М., Сандхольм Дж., Коскинен П.Дж. (февраль 2002 г.). «Передний край: транскрипционная активность NFATc1 усиливается киназой Pim-1» . Журнал иммунологии . 168 (4): 1524–7. DOI : 10.4049 / jimmunol.168.4.1524 . PMID 11823475 .
- Неборовска-Скорска М., Хосер Г., Косев П., Васик М.А., Скорски Т. (июнь 2002 г.). «Дополнительные функции антиапоптотического протеина A1 и серин / треонинкиназы pim-1 в BCR / ABL-опосредованном лейкемогенезе». Кровь . 99 (12): 4531–9. DOI : 10.1182 / blood.V99.12.4531 . PMID 12036885 .
- Bhattacharya N, Wang Z, Davitt C, McKenzie IF, Xing PX, Magnuson NS (июль 2002 г.). «Pim-1 связывается с белковыми комплексами, необходимыми для митоза». Хромосома . 111 (2): 80–95. DOI : 10.1007 / s00412-002-0192-6 . PMID 12111331 . S2CID 26016943 .