Точечная мутация - Point mutation

Точечная мутация или замещение представляет собой генетическую мутацию , где изменяется один нуклеотид основание, вставлен или удален из ДНК или РНК последовательности генома организма. Точечные мутации оказывают разнообразное воздействие на последующий белковый продукт - последствия, которые можно умеренно предсказать, исходя из специфики мутации. Эти последствия могут варьироваться от отсутствия эффекта (например, синонимичные мутации ) до вредных эффектов (например, мутации сдвига рамки считывания ) в отношении продукции, состава и функции белка.
Причины
Точечные мутации обычно происходят во время репликации ДНК . Репликация ДНК происходит, когда одна двухцепочечная молекула ДНК создает две простые цепи ДНК, каждая из которых является матрицей для создания комплементарной цепи. Единственная точечная мутация может изменить всю последовательность ДНК. Замена одного пурина или пиримидина может изменить аминокислоту, которую кодируют нуклеотиды .
Точечные мутации могут возникать в результате спонтанных мутаций , возникающих во время репликации ДНК . Скорость мутации может увеличиваться мутагенами . Мутагены могут быть физическими, такими как излучение ультрафиолетовых лучей , рентгеновских лучей или сильной жары, или химическими (молекулы, которые смещают пары оснований или нарушают спиральную форму ДНК). Мутагены, связанные с раком, часто изучаются, чтобы узнать о раке и его профилактике.
Есть несколько способов возникновения точечных мутаций. Во-первых, ультрафиолетовый (УФ) свет и высокочастотный свет способны ионизировать электроны, которые, в свою очередь, могут влиять на ДНК. Реактивные молекулы кислорода со свободными радикалами, которые являются побочным продуктом клеточного метаболизма, также могут быть очень вредными для ДНК. Эти реагенты могут приводить как к разрывам одноцепочечной ДНК, так и к разрывам двухцепочечной ДНК. В-третьих, связи в ДНК со временем разрушаются, что создает еще одну проблему для поддержания целостности ДНК на высоком уровне. Также могут быть ошибки репликации, которые приводят к мутациям замены, вставки или делеции.
Категоризация
Классификация переходов / трансверсий

В 1959 году Эрнст Фриз ввел термины «переходы» или «трансверсии» для классификации различных типов точечных мутаций. Переходы представляют собой замену пуринового основания другим пурином или замену пиримидина другим пиримидином. Трансверсии - это замена пурина пиримидином или наоборот. Существует систематическая разница в частоте мутаций для переходов (альфа) и трансверсий (бета). Переходные мутации примерно в десять раз чаще, чем трансверсии.
Функциональная категоризация
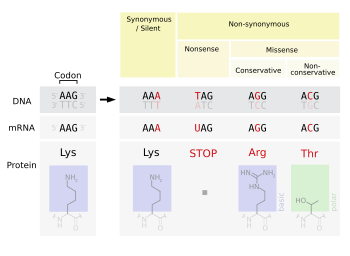
Бессмысленные мутации включают стоп-выигрыш и начало-проигрыш. Stop-gain - это мутация, которая приводит к преждевременному завершению кодона ( стоп- сигнал был получен ), что сигнализирует об окончании трансляции. Это прерывание вызывает аномальное укорачивание белка. Количество потерянных аминокислот влияет на функциональность белка и на то, будет ли он вообще функционировать. Стоп-лосс - это мутация в исходном кодоне терминации ( стоп-сигнал был утерян ), приводящий к аномальному удлинению карбоксильного конца белка. Start-gain создает стартовый кодон AUG перед исходным стартовым сайтом. Если новый AUG находится рядом с исходным стартовым сайтом, в рамке обработанного транскрипта и ниже сайта связывания рибосомы, его можно использовать для инициации трансляции. Вероятный эффект - добавление дополнительных аминокислот к аминоконцу исходного белка. Мутации со сдвигом рамки также возможны при мутациях start-gain, но обычно не влияют на трансляцию исходного белка. Старт-потеря - это точечная мутация в стартовом кодоне AUG транскрипта, приводящая к снижению или устранению продукции белка.
Миссенс-мутации кодируют другую аминокислоту. Миссенс-мутация изменяет кодон так, что создается другой белок, несинонимичное изменение. Консервативные мутации приводят к замене аминокислот. Однако свойства аминокислоты остаются прежними (например, гидрофобность, гидрофильность и т. Д.). Иногда замена одной аминокислоты в белке не наносит вреда организму в целом. Большинство белков могут противостоять одной или двум точечным мутациям, прежде чем их функция изменится. Неконсервативные мутации приводят к замене аминокислоты, которая имеет свойства, отличные от свойств дикого типа . Белок может потерять свою функцию, что может привести к заболеванию организма. Например, серповидно-клеточная анемия вызывается единственной точечной мутацией (миссенс-мутацией) в гене бета- гемоглобина , которая превращает кодон GAG в GUG, который кодирует аминокислоту валин, а не глутаминовую кислоту . Белок также может проявлять «усиление функции» или становиться активированным, например, в случае мутации, изменяющей валин на глутаминовую кислоту в гене BRAF ; это приводит к активации белка RAF, который вызывает неограниченную пролиферативную передачу сигналов в раковых клетках. Это оба примера неконсервативной (миссенс-мутации).
Молчаливые мутации кодируют одну и ту же аминокислоту (« синонимичная замена »). Тихая мутация не влияет на работу белка . Один нуклеотид может измениться, но новый кодон определяет ту же аминокислоту, что приводит к появлению немутантного белка. Этот тип изменения называется синонимичным изменением, поскольку старый и новый кодон кодируются для одной и той же аминокислоты. Это возможно, потому что 64 кодона определяют только 20 аминокислот. Однако разные кодоны могут приводить к разным уровням экспрессии белка.
Вставки и удаления одной пары оснований
Иногда термин точечная мутация используется для описания вставок или делеций одной пары оснований (что оказывает более неблагоприятное влияние на синтезируемый белок из-за того, что нуклеотиды все еще читаются в триплетах, но в разных рамках: мутация, называемая сдвигом рамки считывания. мутация ).
Общие последствия
Точечные мутации, возникающие в некодирующих последовательностях, чаще всего не имеют последствий, хотя бывают и исключения. Если мутированная пара оснований находится в промоторной последовательности гена, то экспрессия гена может измениться. Кроме того, если мутация происходит в сайте сплайсинга интрона , это может помешать правильному сплайсингу транскрибируемой пре-мРНК .
Изменяя только одну аминокислоту, весь пептид может измениться, тем самым изменив весь белок. Новый белок называется вариантом белка . Если исходный белок функционирует в процессе клеточного воспроизводства, то эта одноточечная мутация может изменить весь процесс клеточного воспроизводства для этого организма.
Точечные мутации зародышевой линии могут привести как к полезным, так и к вредным признакам или заболеваниям. Это приводит к адаптации, основанной на среде, в которой живет организм. Выгодная мутация может создать преимущество для этого организма и привести к передаче признака из поколения в поколение, улучшая и принося пользу всему населению. Научная теория эволюции во многом зависит от точечных мутаций в клетках . Теория объясняет разнообразие и историю живых организмов на Земле. Что касается точечных мутаций, в нем говорится, что полезные мутации позволяют организму развиваться и воспроизводиться, тем самым передавая его позитивно затронутые мутировавшие гены следующему поколению. С другой стороны, вредные мутации приводят к гибели организма или снижению вероятности его воспроизводства в результате явления, известного как естественный отбор .
Мутации могут вызывать различные краткосрочные и долгосрочные эффекты. Меньшие из них означали бы остановку клеточного цикла во многих точках. Это означает, что кодон, кодирующий аминокислоту глицин, может быть изменен на стоп-кодон, в результате чего белки, которые должны были быть произведены, деформируются и не могут выполнять свои намеченные задачи. Поскольку мутации могут влиять на ДНК и, следовательно, на хроматин , они могут препятствовать митозу из-за отсутствия полной хромосомы. Проблемы также могут возникать во время процессов транскрипции и репликации ДНК. Все это препятствует размножению клетки и, таким образом, приводит к ее гибели. Долгосрочные последствия могут заключаться в необратимом изменении хромосомы, что может привести к мутации. Эти мутации могут быть как полезными, так и вредными. Рак - это пример того, как они могут быть вредными.
Другие эффекты точечных мутаций или однонуклеотидных полиморфизмов в ДНК зависят от локализации мутации в гене. Например, если мутация происходит в области гена, ответственного за кодирование, аминокислотная последовательность кодируемого белка может быть изменена, вызывая изменение функции, локализации белка, стабильности белка или белкового комплекса. Было предложено множество методов для прогнозирования воздействия миссенс-мутаций на белки. Алгоритмы машинного обучения обучают свои модели отличать известные мутации, связанные с заболеванием, от нейтральных мутаций, тогда как другие методы не обучают свои модели явным образом, но почти все методы используют эволюционное сохранение, предполагая, что изменения в сохраненных положениях имеют тенденцию быть более вредными. В то время как большинство методов обеспечивают бинарную классификацию эффектов мутаций на повреждающие и доброкачественные, необходим новый уровень аннотации, чтобы предложить объяснение того, почему и как эти мутации повреждают белки.
Более того, если мутация происходит в области гена, где транскрипционный аппарат связывается с белком, мутация может повлиять на связывание факторов транскрипции, поскольку короткие нуклеотидные последовательности, распознаваемые факторами транскрипции, будут изменены. Мутации в этой области могут влиять на эффективность транскрипции гена, что, в свою очередь, может изменять уровни мРНК и, таким образом, уровни белка в целом.
Точечные мутации могут иметь несколько эффектов на поведение и воспроизводство белка в зависимости от того, где мутация происходит в аминокислотной последовательности белка. Если мутация происходит в области гена, который отвечает за кодирование белка, аминокислота может быть изменена. Это небольшое изменение в последовательности аминокислот может вызвать изменение функции, активацию белка, означающую, как он связывается с данным ферментом, где белок будет располагаться внутри клетки, или количество свободной энергии, хранящейся в белке. .
Если мутация происходит в области гена, где транскрипционный аппарат связывается с белком, мутация может повлиять на способ связывания факторов транскрипции с белком. Механизмы транскрипции связываются с белком посредством распознавания коротких нуклеотидных последовательностей. Мутация в этой области может изменить эти последовательности и, таким образом, изменить способ связывания факторов транскрипции с белком. Мутации в этой области могут влиять на эффективность транскрипции гена, которая контролирует как уровни мРНК, так и общие уровни белка.
Специфические заболевания, вызванные точечными мутациями
Рак
Точечные мутации в нескольких белках-супрессорах опухолей вызывают рак . Например, точечные мутации в аденоматозном полипозе кишечной палочки способствуют онкогенезу. Новый анализ, быстрый параллельный протеолиз (FASTpp) , может помочь в быстром скрининге специфических дефектов стабильности у отдельных онкологических больных.
Нейрофиброматоз
Нейрофиброматоз вызывается точечными мутациями в гене нейрофибромина 1 или нейрофибромина 2 .
Серповидноклеточная анемия
Серповидно-клеточная анемия вызывается точечной мутацией в β-глобиновой цепи гемоглобина, в результате которой гидрофильная аминокислота глутаминовая кислота заменяется гидрофобной аминокислотой валином в шестом положении.
Ген β-глобина находится на коротком плече хромосомы 11. Ассоциация двух субъединиц α-глобина дикого типа с двумя субъединицами мутантного β-глобина образует гемоглобин S (HbS). В условиях низкого содержания кислорода (например, на большой высоте) отсутствие полярной аминокислоты в шестом положении β-глобиновой цепи способствует нековалентной полимеризации (агрегации) гемоглобина, что искажает эритроциты в серповидной формы и снижает их эластичность.
Гемоглобин - это белок, содержащийся в красных кровяных тельцах, который отвечает за транспортировку кислорода по телу. Белок гемоглобина состоит из двух субъединиц: бета-глобинов и альфа-глобинов . Бета-гемоглобин создается из генетической информации о гене HBB или «гемоглобина бета», обнаруженном на хромосоме 11p15.5. Одноточечная мутация в этой полипептидной цепи, длина которой составляет 147 аминокислот, приводит к заболеванию, известному как серповидноклеточная анемия. Серповидно-клеточная анемия - аутосомно-рецессивное заболевание, которым страдает 1 из 500 афроамериканцев, и является одним из наиболее распространенных заболеваний крови в Соединенных Штатах. Однократная замена шестой аминокислоты в бета-глобине, глутаминовой кислоты, на валин приводит к деформированию эритроцитов. Эти серповидные клетки не могут переносить столько кислорода, сколько нормальные эритроциты, и они легче захватываются капиллярами, перекрывая кровоснабжение жизненно важных органов. Изменение одного нуклеотида в бета-глобине означает, что даже малейшее усилие со стороны носителя приводит к сильной боли и даже сердечному приступу. Ниже приведена диаграмма, изображающая первые тринадцать аминокислот в нормальной и аномальной полипептидной цепи серповидно-клеточной анемии .
| АВГУСТ | GUG | САС | CUG | ACU | CCU | G A G | GAG | AAG | УКУ | GCC | ГУ | ACU |
| НАЧНИТЕ | Вал | Его | Лея | Thr | Pro | Glu | Glu | Lys | Сер | Ала | Вал | Thr |
| АВГУСТ | GUG | САС | CUG | ACU | CCU | G U G | GAG | AAG | УКУ | GCC | ГУ | ACU |
| НАЧНИТЕ | Вал | Его | Лея | Thr | Pro | Вал | Glu | Lys | Сер | Ала | Вал | Thr |
Болезнь Тея – Сакса
Причина болезни Тея – Сакса - генетический дефект, который передается от родителей к ребенку. Этот генетический дефект находится в гене HEXA, который находится на хромосоме 15.
Ген HEXA является частью фермента, называемого бета-гексозаминидаза А, который играет важную роль в нервной системе. Этот фермент помогает расщеплять в нервных клетках жирное вещество, называемое ганглиозидом GM2. Мутации в гене HEXA нарушают активность бета-гексозаминидазы A, предотвращая распад жирных веществ. В результате жирные вещества накапливаются в головном и спинном мозге до смертельного уровня. Накопление ганглиозида GM2 вызывает прогрессирующее повреждение нервных клеток. Это причина признаков и симптомов болезни Тея-Сакса.
Дальтоник
У людей с дальтонизмом есть мутации в генах, которые вызывают потерю красных или зеленых колбочек, и поэтому им трудно различать цвета. В человеческом глазу есть три вида колбочек: красные, зеленые и синие. Теперь исследователи обнаружили, что некоторые люди с генной мутацией, вызывающей дальтонизм, теряют весь набор «цветных» колбочек без изменения четкости их зрения в целом.
Точечная мутация, индуцированная повтором
В молекулярной биологии , повтор индуцированного точечной мутации или RIP представляет собой процесс , с помощью которого ДНК накапливается G : C к A : T переходные мутация. Геномные данные указывают на то, что RIP встречается или имел место у различных грибов, в то время как экспериментальные данные показывают, что RIP активен в Neurospora crassa , Podospora anserina , Magnaporthe grisea , Leptosphaeria maculans , Gibberella zeae и Nectria haematococca . У Neurospora crassa последовательности, мутировавшие с помощью RIP, часто метилируются de novo .
RIP происходит во время половой стадии в гаплоидных ядрах после оплодотворения, но до репликации мейотической ДНК . В Neurospora сгазза , повторяющиеся последовательности по меньшей мере 400 пар оснований в длину уязвимы для RIP. Повторы с нуклеотидной идентичностью всего на 80% также могут быть объектом RIP. Хотя точный механизм распознавания повторов и мутагенеза плохо изучены, RIP приводит к повторяющимся последовательностям, претерпевающим множественные переходные мутации .
Мутации RIP, по-видимому, не ограничиваются повторяющимися последовательностями. Действительно, например, у фитопатогенного гриба L. maculans мутации RIP обнаруживаются в областях единственной копии, смежных с повторяющимися элементами. Эти области представляют собой либо некодирующие области, либо гены, кодирующие небольшие секретируемые белки, включая гены авирулентности. Степень RIP в этих областях единственной копии была пропорциональна их близости к повторяющимся элементам.
Реп и Кистлер предположили, что присутствие очень повторяющихся областей, содержащих транспозоны, может способствовать мутации резидентных эффекторных генов. Таким образом, предполагается, что присутствие эффекторных генов в таких регионах способствует их адаптации и диверсификации при воздействии сильного давления отбора.
Поскольку традиционно наблюдается, что мутация RIP ограничивается повторяющимися областями, а не областями единичных копий, Fudal et al. предположили, что утечка мутации RIP может происходить на относительно коротком расстоянии от повтора, затронутого RIP. Действительно, об этом сообщалось у N. crassa, в результате чего утечка RIP была обнаружена в последовательностях с одной копией, по крайней мере, 930 п.н. от границы соседних дублированных последовательностей. Выяснение механизма обнаружения повторяющихся последовательностей, ведущих к RIP, может позволить понять, как могут быть затронуты фланкирующие последовательности.
Механизм
RIP вызывает мутации перехода из G : C в A : T в повторах, однако механизм обнаружения повторяющихся последовательностей неизвестен. RID - единственный известный белок, необходимый для RIP. Это ДНК-метилтрансферазоподобный белок, который при мутации или нокауте приводит к потере RIP. Удаление гомолога rid у Aspergillus nidulans , dmtA , приводит к потере фертильности, в то время как делеция гомолога rid у Ascobolus immersens , masc1 , приводит к дефектам фертильности и потере метилирования, индуцированного премейотически (MIP) .
Последствия
Считается, что RIP превратился в механизм защиты от мобильных элементов , которые напоминают паразитов , вторгаясь и размножаясь в геноме. RIP создает несколько Миссенс и нонсенс - мутации в кодирующей последовательности. Эта гипермутация GC в AT в повторяющихся последовательностях устраняет функциональные генные продукты последовательности (если таковые были вначале). Кроме того, многие из C-несущих нуклеотидов становятся метилированными , что снижает транскрипцию.
Использование в молекулярной биологии
Поскольку RIP настолько эффективен при обнаружении и мутации повторов, грибковые биологи часто используют его как инструмент для мутагенеза . Вторая копия гена с одной копией сначала трансформируется в геном . Затем гриб должен спариваться и пройти свой половой цикл, чтобы активировать механизм RIP. Множество различных мутаций в дублированном гене получается даже в результате одного случая оплодотворения, так что могут быть получены инактивированные аллели, обычно из-за бессмысленных мутаций , а также аллели, содержащие миссенс-мутации .
История
Процесс клеточного воспроизводства мейоза был открыт Оскаром Хертвигом в 1876 году. Митоз был открыт несколькими годами позже, в 1882 году, Вальтером Флеммингом .
Хертвиг изучил морских ежей и заметил, что каждое яйцо содержало одно ядро до оплодотворения и два ядра после него. Это открытие доказало, что один сперматозоид может оплодотворить яйцеклетку, и, следовательно, доказало процесс мейоза. Германн Фоль продолжил исследования Хертвига, проверив эффекты инъекции нескольких сперматозоидов в яйцеклетку, и обнаружил, что этот процесс не работает более чем с одним сперматозоидом.
Флемминг начал свои исследования деления клеток, начиная с 1868 года. Изучение клеток становилось все более популярной темой в этот период времени. К 1873 году Шнайдер уже начал описывать этапы деления клеток. Флемминг продолжил это описание в 1874 и 1875 годах, объясняя шаги более подробно. Он также спорил с выводами Шнайдера о том, что ядро разделилось на стержневидные структуры, предполагая, что ядро фактически разделилось на нити, которые, в свою очередь, разделились. Флемминг пришел к выводу, что клетки реплицируются посредством деления клеток, а точнее митоза.
Мэтью Мезельсон и Франклин Шталь приписывают открытие репликации ДНК . Уотсон и Крик признали, что структура ДНК действительно указывает на то, что существует некоторая форма процесса репликации. Однако до Уотсона и Крика не было проведено много исследований по этому аспекту ДНК. Люди рассматривали все возможные методы определения процесса репликации ДНК, но ни один из них не был успешным до Мезельсона и Шталя. Мезельсон и Шталь ввели тяжелый изотоп в часть ДНК и проследили его распространение. С помощью этого эксперимента Мезельсон и Шталь смогли доказать, что ДНК воспроизводится полуконсервативно.
Смотрите также
использованная литература
внешние ссылки
- Point + Mutation в Национальной медицинской библиотеке США по предметным заголовкам по медицинским предметам (MeSH)