Запрограммированная гибель клеток - Programmed cell death
Запрограммированная гибель клеток ( PCD , иногда называют клеточным самоубийством ) является смертью из клетки в результате событий внутри ячейки, например, апоптоза или аутофагии . PCD осуществляется в рамках биологического процесса , который обычно дает преимущество в течение жизненного цикла организма . Например, дифференциация пальцев рук и ног в развивающемся человеческом эмбрионе происходит из-за апоптоза клеток между пальцами ; в результате цифры разделены. PCD выполняет фундаментальные функции как у растений, так и у животных. развитие тканей.
Апоптоз и аутофагия являются формами запрограммированной гибели клеток. Некроз - это смерть клетки, вызванная внешними факторами, такими как травма или инфекция, и происходит в нескольких различных формах. Некроз долгое время считался нефизиологическим процессом, который возникает в результате инфекции или травмы, но в 2000-х годах форма запрограммированного некроза, называемая некроптозом , была признана альтернативной формой запрограммированной гибели клеток. Предполагается, что некроптоз может служить резервом клеточной смерти для апоптоза, когда передача сигналов апоптоза блокируется эндогенными или экзогенными факторами, такими как вирусы или мутации. Совсем недавно были обнаружены и другие типы регулируемого некроза, которые разделяют несколько сигнальных событий с некроптозом и апоптозом.
История
Концепция «запрограммированной клеточной смерти» была использована Локшином и Уильямсом в 1964 году в отношении развития тканей насекомых , примерно за восемь лет до того, как был придуман «апоптоз». Однако термин PCD был источником путаницы, и Дюран и Рэмси разработали эту концепцию, предоставив механистические и эволюционные определения. PCD стал общим термином, который относится ко всем различным типам гибели клеток, имеющим генетический компонент.
Первое понимание механизма было получено при изучении BCL2 , продукта предполагаемого онкогена, активируемого хромосомными транслокациями, часто обнаруживаемых при фолликулярной лимфоме . В отличие от других раковых генов, которые способствуют развитию рака , стимулируя пролиферацию клеток, BCL2 способствует развитию рака, не позволяя клеткам лимфомы убивать себя.
PCD является предметом растущего внимания и исследовательских усилий. Эта тенденция была выделена с вручением 2002 Нобелевской премии по физиологии и медицине в Сидней Бреннер ( Соединенное Королевство ), Роберт Хорвиц (США) и Джон Е. Sulston (Великобритания).
Типы

- Апоптоз или гибель клеток I типа.
- Аутофагическая гибель клеток или гибель клеток II типа. ( Цитоплазматический : характеризуется образованием больших вакуолей, которые разъедают органеллы в определенной последовательности до разрушения ядра .)
Апоптоз
Апоптоз - это процесс запрограммированной гибели клеток (PCD), который может происходить в многоклеточных организмах . Биохимические события приводят к характерным изменениям ( морфологии ) и гибели клеток . Эти изменения включают блеббинг , сжатие клеток, фрагментацию ядер , конденсацию хроматина и фрагментацию хромосомной ДНК . Сейчас считается, что - в контексте развития - клетки побуждаются к позитивному самоубийству, находясь в гомеостатическом контексте; отсутствие определенных факторов выживания может стать толчком к самоубийству. По-видимому, существуют некоторые вариации в морфологии и даже в биохимии этих путей самоубийства; одни идут по пути «апоптоза», другие идут по более обобщенному пути к делеции, но оба обычно имеют генетическую и синтетическую мотивацию. Есть некоторые свидетельства того, что определенные симптомы «апоптоза», такие как активация эндонуклеаз, могут быть ложно вызваны без участия генетического каскада, однако, по-видимому, истинный апоптоз и запрограммированная гибель клеток должны быть генетически опосредованы. Также становится ясно, что митоз и апоптоз каким-то образом переключаются или связаны, и что достигнутый баланс зависит от сигналов, полученных от соответствующих факторов роста или выживания.
Аутофагия
Macroautophagy , часто упоминается как аутофагией , является катаболический процесс , который приводит к autophagosomic - лизосомальных деградации сыпучих цитоплазматических содержание, ненормальных белковых агрегатов, а избыток или поврежденных органелл .
Аутофагия обычно активируется в условиях недостатка питательных веществ, но также связана с физиологическими и патологическими процессами, такими как развитие, дифференциация, нейродегенеративные заболевания , стресс , инфекции и рак .
Механизм
Критическим регулятором индукции аутофагии является киназа mTOR , которая при активации подавляет аутофагию, а когда не активируется, способствует ей. Три родственные серин / треониновые киназы, UNC-51-подобные киназы -1, -2 и -3 (ULK1, ULK2, UKL3), которые играют ту же роль, что и дрожжевой Atg1 , действуют ниже комплекса mTOR . ULK1 и ULK2 образуют большой комплекс с гомологом млекопитающего продукта гена, связанного с аутофагией (Atg) (mAtg13), и каркасного белка FIP200. Комплекс PI3K класса III, содержащий hVps34, Beclin-1 , p150 и Atg14-подобный белок или ген, связанный с устойчивостью к ультрафиолетовому облучению (UVRAG), необходим для индукции аутофагии.
Эти ATG гены контролируют аутофагос образование посредством Atg12 - ATG5 и LC3-II ( Atg8 -II) комплексы. ATG12 конъюгирован с ATG5 в реакции, подобной убиквитину, для которой требуются ATG7 и ATG10 . Конъюгат Atg12-Atg5 затем нековалентно взаимодействует с ATG16 с образованием большого комплекса. LC3 / ATG8 расщепляется на своем С-конце протеазой ATG4 с образованием цитозольного LC3-I. LC3-I конъюгирован с фосфатидилэтаноламином (PE) также в убиквитиноподобной реакции, для которой требуются Atg7 и Atg3. Липидированная форма LC3, известная как LC3-II, прикрепляется к мембране аутофагосомы.
Аутофагия и апоптоз связаны как положительно, так и отрицательно, и между ними существует обширная перекрестная помеха. Во время дефицита питательных веществ , автофагия функционирует как механизм про выживание, однако, чрезмерная аутофагия может привести к гибели клеток , процесс морфологический отличающемуся от апоптоза . Некоторые проапоптотические сигналы , такие как TNF , TRAIL и FADD , также вызывают аутофагию. Кроме того, Bcl-2 ингибирует Beclin-1-зависимую аутофагию, тем самым действуя как регулятор выживания, так и антиаутофагический регулятор.
Другие типы
Помимо двух вышеупомянутых типов PCD, были обнаружены и другие пути. Называемые « неапоптотической запрограммированной гибелью клеток» (или « независимой от каспаз запрограммированной гибелью клеток» или «некроптозом»), эти альтернативные пути к смерти столь же эффективны, как и апоптоз, и могут действовать как резервные механизмы, так и как основной тип PCD. .
Другие формы запрограммированной гибели клеток включают аноикис , почти идентичный апоптозу, за исключением его индукции; ороговение , форма гибели клеток исключительно для глаз; эксайтотоксичность ; ферроптоз , железозависимая форма гибели клеток и валлеровская дегенерация .
Некроптоз - это запрограммированная форма некроза или воспалительной гибели клеток. Обычно некроз связан с незапрограммированной гибелью клеток в результате клеточного повреждения или инфильтрации патогенами, в отличие от упорядоченной запрограммированной гибели клеток через апоптоз . Немоз - еще одна запрограммированная форма некроза фибробластов .
Эриптоз - это форма суицидальной гибели эритроцитов .
Апонекроз представляет собой гибрид апоптоза и некроза и относится к неполному апоптотическому процессу, который завершается некрозом.
НЕТоз - это процесс гибели клеток, вызванный НЕТ .
Параптоз - это еще один тип неапоптотической гибели клеток, который опосредуется MAPK через активацию IGF-1 . Он характеризуется внутриклеточным образованием вакуолей и набуханием митохондрий.
Пироптоз , воспалительный тип гибели клеток, однозначно опосредуется каспазой 1 , ферментом, не участвующим в апоптозе, в ответ на инфекцию определенными микроорганизмами.
Клетки растений подвергаются особым процессам PCD, подобным гибели аутофагических клеток. Однако некоторые общие черты PCD в высокой степени сохраняются как у растений, так и у многоклеточных.
Атрофические факторы
Атрофический фактором является силой , которая вызывает клетки , чтобы умереть . Только естественные силы, воздействующие на клетку, считаются атрофическими факторами, тогда как, например, агенты механического или химического воздействия или лизиса клетки не считаются атрофическими факторами. Распространенными типами атрофических факторов являются:
- Сниженная нагрузка
- Потеря иннервации
- Снижение кровоснабжения
- Неполноценное питание
- Потеря эндокринной стимуляции
- Старость
- Сжатие
Роль в развитии нервной системы
Первоначальное расширение развивающейся нервной системы уравновешивается удалением нейронов и их отростков. Во время развития нервной системы почти 50% развивающихся нейронов естественным образом удаляются в результате запрограммированной гибели клеток (PCD). PCD в нервной системе был впервые обнаружен в 1896 году Джоном Бирдом. С тех пор было предложено несколько теорий, чтобы понять его биологическое значение во время развития нервной системы .
Роль в развитии нервной системы
PCD в развивающейся нервной системе наблюдается как в пролиферирующих, так и в постмитотических клетках. Одна теория предполагает, что PCD - это адаптивный механизм, регулирующий количество клеток-предшественников . У людей PCD в клетках-предшественниках начинается на 7 неделе гестации и сохраняется до первого триместра. Этот процесс гибели клеток был идентифицирован в зародышевых областях коры головного мозга , мозжечка , таламуса , ствола мозга и спинного мозга среди других областей. На 19–23 неделе гестации в постмитотических клетках наблюдается PCD. Преобладающей теорией, объясняющей это наблюдение, является нейротрофическая теория, которая утверждает, что PCD требуется для оптимизации связи между нейронами и их афферентными входами и эфферентными мишенями. Другая теория предполагает, что PCD развития в нервной системе происходит для исправления ошибок в нейронах, которые мигрировали эктопически, иннервируют неправильные мишени или имеют аксоны , которые пошли не так во время поиска пути. Возможно, что PCD во время развития нервной системы выполняет различные функции, определяемые стадией развития, типом клеток и даже видами.
Нейротрофическая теория
Нейротрофическая теория - это ведущая гипотеза, используемая для объяснения роли запрограммированной гибели клеток в развивающейся нервной системе. Он постулирует, что для обеспечения оптимальной иннервации мишеней сначала создается избыток нейронов, которые затем конкурируют за ограниченное количество защитных нейротрофических факторов, и только часть выживает, в то время как другие умирают в результате запрограммированной гибели клеток. Более того, теория утверждает, что предопределенные факторы регулируют количество выживших нейронов, а размер популяции иннервирующих нейронов напрямую коррелирует с влиянием их целевого поля.
Основная идея о том, что клетки-мишени выделяют привлекательные или индуцирующие факторы и что их ростовые конусы обладают хемотаксической чувствительностью, была впервые выдвинута Сантьяго Рамоном-и-Кахалем в 1892 году. Кахал представил эту идею как объяснение того, что аксоны «разумной силы», по-видимому, принимают, когда нашел свою цель, но признал, что у него нет эмпирических данных. Теория стала более привлекательной, когда экспериментальные манипуляции с мишенями аксонов привели к гибели всех иннервирующих нейронов. Это привело к развитию концепции регуляции, производной от мишени, которая стала основным принципом нейротрофической теории. Эксперименты, которые еще больше подтвердили эту теорию, привели к идентификации первого нейротрофического фактора, фактора роста нервов (NGF).
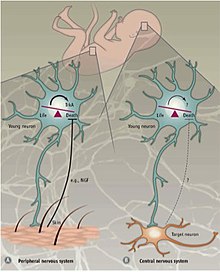
Периферийная и центральная нервная система
Различные механизмы регулируют PCD в периферической нервной системе (PNS) по сравнению с центральной нервной системой (CNS). В ПНС иннервация мишени пропорциональна количеству высвобождаемых мишенью нейротрофических факторов NGF и NT3 . Экспрессии рецепторов нейротрофина, TrkA и TrkC , достаточно для индукции апоптоза в отсутствие их лигандов . Таким образом, предполагается, что PCD в PNS зависит от высвобождения нейротрофических факторов и, таким образом, следует концепции нейротрофической теории.
Запрограммированная гибель клеток в ЦНС не зависит от внешних факторов роста, а зависит от внутренних сигналов. В неокортексе соотношение возбуждающих и тормозящих интернейронов 4: 1 поддерживается апоптотическим аппаратом, который, по-видимому, не зависит от окружающей среды. Подтверждающие доказательства были получены из эксперимента, в котором предшественники интернейронов были либо трансплантированы в неокортекс мыши, либо культивированы in vitro . Пересаженные клетки погибли в возрасте двух недель, в том же возрасте, в котором эндогенные интернейроны подвергаются апоптозу. Независимо от размера трансплантата, доля клеток, подвергающихся апоптозу, оставалась постоянной. Кроме того, нарушение TrkB , рецептора нейротрофического фактора головного мозга (Bdnf), не влияло на гибель клеток. Также было показано, что у мышей, у которых отсутствует проапоптотический фактор Bax (Bcl-2-связанный X-белок), выживает больший процент интернейронов по сравнению с мышами дикого типа. Вместе эти находки указывают на то, что запрограммированная гибель клеток в ЦНС частично использует Bax-опосредованную передачу сигналов и не зависит от BDNF и окружающей среды. Механизмы апоптоза в ЦНС до сих пор недостаточно изучены, но считается, что апоптоз интернейронов является самоавтономным процессом.
Развитие нервной системы при ее отсутствии
Запрограммированная гибель клеток может быть уменьшена или устранена в развивающейся нервной системе посредством целенаправленной делеции проапоптотических генов или сверхэкспрессии антиапоптотических генов. Отсутствие или уменьшение PCD может вызвать серьезные анатомические аномалии, но также может привести к минимальным последствиям в зависимости от целевого гена, популяции нейронов и стадии развития. Избыточная пролиферация клеток-предшественников, которая приводит к грубым аномалиям мозга, часто приводит к летальному исходу, как это наблюдается у мышей с нокаутом по каспазе-3 или каспазе-9, у которых развивается экзэнцефалия в переднем мозге . Ствол мозга, спинной мозг и периферические ганглии этих мышей развиваются нормально, однако, это позволяет предположить, что участие каспаз в PCD во время развития зависит от области мозга и типа клеток. Нокаут или ингибирование фактора 1, активирующего апоптотические протеазы ( APAF1 ), также приводит к порокам развития и повышенной эмбриональной летальности. Манипулирование белками - регуляторами апоптоза Bcl-2 и Bax (сверхэкспрессия Bcl-2 или делеция Bax) вызывает увеличение количества нейронов в определенных областях нервной системы, таких как сетчатка , ядро тройничного нерва , мозжечок и спинной мозг. Однако PCD нейронов из-за делеции Bax или сверхэкспрессии Bcl-2 не приводит к заметным морфологическим или поведенческим аномалиям у мышей. Например, мыши со сверхэкспрессией Bcl-2 обычно имеют нормальные моторные навыки и зрение и демонстрируют нарушения только в сложных формах поведения, таких как обучение и тревожность. Нормальные поведенческие фенотипы этих мышей предполагают, что может быть задействован адаптивный механизм для компенсации избытка нейронов.
Беспозвоночные и позвоночные
Изучение PCD у различных видов важно для понимания эволюционной основы и причины апоптоза в развитии нервной системы. В процессе развития нервной системы беспозвоночных PCD играет разные роли у разных видов. Сходство асимметричного механизма гибели клеток у нематоды и пиявки указывает на то, что PCD может иметь эволюционное значение в развитии нервной системы. У нематод PCD возникает в первый час развития, что приводит к элиминации 12% негонадных клеток, включая нейрональные клоны. Гибель клеток у членистоногих происходит сначала в нервной системе, когда клетки эктодермы дифференцируются, и одна дочерняя клетка становится нейробластом, а другая подвергается апоптозу. Более того, гибель клеток, нацеленных на пол, приводит к разной иннервации нейронов определенных органов у мужчин и женщин. У Drosophila PCD важен для сегментации и спецификации во время развития.
В отличие от беспозвоночных, механизм запрограммированной гибели клеток у позвоночных более консервативен . Обширные исследования, проведенные на различных позвоночных, показывают, что PCD нейронов и глии возникает в большинстве частей нервной системы во время развития. Это наблюдалось до и во время синаптогенеза в центральной нервной системе, а также в периферической нервной системе. Однако между видами позвоночных есть несколько различий. Например, у млекопитающих наблюдается обширное ветвление с последующим PCD в сетчатке, в то время как у птиц этого не происходит. Хотя синаптическое совершенствование в системах позвоночных в значительной степени зависит от PCD, другие эволюционные механизмы также играют роль.
В растительной ткани
Запрограммированная гибель клеток растений имеет ряд молекулярных сходств с апоптозом животных , но также имеет различия, наиболее очевидными из которых являются наличие клеточной стенки и отсутствие иммунной системы, которая удаляет части мертвой клетки. Вместо иммунного ответа умирающая клетка синтезирует вещества, которые разрушаются, и помещает их в вакуоль, которая разрывается, когда клетка умирает.
В статье «APL регулирует идентичность сосудистой ткани у арабидопсиса » Мартин Бонке и его коллеги заявили, что одна из двух систем дальнего транспорта сосудистых растений , ксилема , состоит из нескольких типов клеток, дифференциация которых включает отложение сложных клеток. - утолщение стенок и запрограммированная гибель клеток ». Авторы подчеркивают, что продукты ПХД растений играют важную структурную роль.
Основные морфологические и биохимические особенности PCD были сохранены в обоих растений и животных царств . Определенные типы растительных клеток реализуют уникальные программы гибели клеток. Они имеют общие черты с апоптозом животных - например, деградацию ядерной ДНК - но у них также есть свои особенности, такие как ядерная деградация, вызванная коллапсом вакуоли в трахеальных элементах ксилемы.
Janneke Балк и Кристофер Дж Ливер, Департамента растений наук , Оксфордский университет , проведены исследования по мутации в митохондриального генома в ВС-цветочных клеток. Результаты этого исследования показывают, что митохондрии играют такую же ключевую роль в PCD сосудистых растений, как и в других эукариотических клетках.
PCD в пыльце предотвращает инбридинг
Во время опыления растения применяют самонесовместимость ( SI ) как важное средство предотвращения самоопыления . Исследования на кукурузном мака ( мак самосейка ) показали , что белки в пестике , на которых пыльцевые земли, взаимодействует с пыльцой и спусковым PCD в несовместимой (т.е. я ) пыльце. Исследователи Стивен Г. Томас и Верноника Э. Франклин-Тонг также обнаружили, что ответная реакция включает быстрое подавление роста пыльцевых трубок с последующим PCD.
В формах слизи
Социальные слизевики Dictyostelium discoideum имеет особенность либо принятия хищных амеб -подобного поведения в его одноклеточный форме или коалесценции в мобильный нерасклепанную -подобных форме , когда диспергирование споров , которые дадут рождение следующему поколению .
Стебель состоит из мертвых клеток, которые подверглись типу PCD, который имеет много общих черт с аутофагической гибелью клеток: массивные вакуоли, образующиеся внутри клеток, некоторая степень конденсации хроматина , но отсутствие фрагментации ДНК . Структурная роль остатков, оставленных мертвыми клетками, напоминает продукты PCD в растительной ткани.
D. discoideum - это слизистая плесень, часть ветви, которая могла возникнуть от предков эукариот примерно за миллиард лет до настоящего времени. Кажется, что они возникли после того, как предки зеленых растений и предки грибов и животных дифференцировались. Но, в дополнение к их месту в эволюционном дереве , тот факт , что PCD наблюдался в скромной, простой, шести- хромосомы D. discoideum имеет дополнительное значение: Это позволяет изучать на развивающего пути PCD , который не зависит от каспаз характеристика апоптоза.
Эволюционное происхождение митохондриального апоптоза
Возникновение запрограммированной гибели клеток у протистов возможно, но остается спорным. Некоторые относят смерть этих организмов к нерегулируемой гибели клеток, подобной апоптозу.
Биологи давно подозревали, что митохондрии произошли от бактерий , которые были включены в качестве эндосимбионтов («живущих вместе внутри») более крупных эукариотических клеток. Именно Линн Маргулис с 1967 года отстаивала эту теорию , которая с тех пор получила широкое признание. Наиболее убедительным доказательством этой теории является тот факт, что митохондрии обладают собственной ДНК и оснащены генами и аппаратом репликации .
Этот эволюционный шаг был бы рискованным для примитивных эукариотических клеток, которые начали поглощать бактерии, производящие энергию , а также опасным шагом для предков митохондрий, которые начали вторгаться в их протоэукариотические хозяева . Этот процесс все еще очевиден сегодня, между человеческими белыми кровяными клетками и бактерий. В большинстве случаев вторгшиеся бактерии уничтожаются лейкоцитами; однако нередки случаи, когда химическая война, ведущаяся прокариотами , бывает успешной, с последствием, известным как инфекция , в результате нанесенного ею ущерба.
Одно из этих редких эволюционных событий, произошедшее примерно за два миллиарда лет до настоящего времени, позволило некоторым эукариотам и прокариотам, производящим энергию, сосуществовать и получать взаимную выгоду от своего симбиоза .
Митохондриальные эукариотические клетки живут между жизнью и смертью, потому что митохондрии все еще сохраняют свой набор молекул, которые могут вызвать самоубийство клетки. Неясно, почему аппарат апоптоза сохраняется у современных одноклеточных организмов. Теперь этот процесс должен происходить только тогда, когда он запрограммирован. клеткам (например, обратная связь от соседей, стресс или повреждение ДНК ) митохондрии выделяют активаторы каспаз , которые запускают биохимический каскад, вызывающий гибель клеток . Таким образом, механизм клеточного самоубийства теперь имеет решающее значение для всей нашей жизни.
Запрограммированная смерть целых организмов
Клиническое значение
ABL
Было обнаружено, что онкоген BCR-ABL участвует в развитии рака у людей.
c-Myc
c-Myc участвует в регуляции апоптоза через свою роль в подавлении гена Bcl-2 . Его роль в нарушенном росте тканей.
Метастаз
Молекулярная характеристика метастатических клеток является их измененной экспрессией нескольких генов апоптоза.
Смотрите также
- Аноикис
- Фактор, вызывающий апоптоз
- Апоптоз против псевдоапоптоза
- Апоптосома
- Апоптотическая фрагментация ДНК
- Автолиз (биология)
- Аутофагия
- Автощизис
- Bcl-2
- Агонист смерти взаимодействующего домена BH3 (BID)
- Calpains
- Каспасы
- Повреждение клеток
- Корнификация
- Цитохром с
- Цитотоксичность
- Гомолог Diablo
- Entosis
- Эксайтотоксичность
- Ферроптоз
- Инфламмасома
- Митохондриальная проницаемость переходной поры
- Митотическая катастрофа
- Некробиология
- Некроптоз
- Некроз
- Модулятор апоптоза с повышенной регуляцией p53 (PUMA)
- Параптоз
- Партанатос
- Пироптоз
- Киназы RIP
- Валлеровское вырождение
Примечания и ссылки
- Шривастава, RE в молекулярных механизмах (Humana Press, 2007).
- Кирзенбаум, AL & Tres, LL (редактор Мадлен Хайд) (ELSEVIER SAUNDERS, Филадельфия, 2012).