ПД-Л1 - PD-L1
Запрограммированную смерть-лиганд 1 (PD-L1) , также известный как кластер дифференцировки 274 (CD274) или В7 гомолог 1 (В7-Н1) представляет собой белок , который у человека кодируется CD274 гена .
Лиганд запрограммированной смерти 1 (PD-L1) представляет собой трансмембранный белок 40 кДа типа 1 , который, как предполагалось, играет важную роль в подавлении адаптивного звена иммунной системы во время определенных событий, таких как беременность , тканевые аллотрансплантаты , аутоиммунное заболевание и другие болезненные состояния. например, гепатит . Обычно адаптивная иммунная система реагирует на антигены , связанные с активацией иммунной системы, экзогенными или эндогенными сигналами опасности . В свою очередь, размножается клональная экспансия антиген- специфичных CD8 + Т-клеток и / или CD4 + хелперных клеток . Связывание PD-L1 с молекулой ингибиторной контрольной точки PD-1 передает ингибирующий сигнал, основанный на взаимодействии с фосфатазами ( SHP-1 или SHP-2 ) через иммунорецепторный тирозиновый переключающий мотив (ITSM). Это снижает пролиферацию антиген-специфических Т-клеток в лимфатических узлах, одновременно уменьшая апоптоз в регуляторных Т-клетках (противовоспалительных, супрессивных Т-клетках), что дополнительно опосредовано более низкой регуляцией гена Bcl-2 .
История
PD-L1 был охарактеризован в клинике Мэйо как иммунорегуляторная молекула B7-H1. Позже эта молекула была переименована в PD-L1, поскольку она была идентифицирована как лиганд PD-1. Некоторые раковые клетки человека экспрессировали высокие уровни B7-H1, а блокада B7-H1 уменьшала рост опухолей в присутствии иммунных клеток. В то время был сделан вывод, что B7-H1 помогает опухолевым клеткам уклоняться от противоопухолевого иммунитета. В 2003 году было показано, что B7-H1 экспрессируется на миелоидных клетках в качестве белка контрольной точки и был предложен в качестве потенциальной мишени в иммунотерапии рака в клинике человека.
Привязка
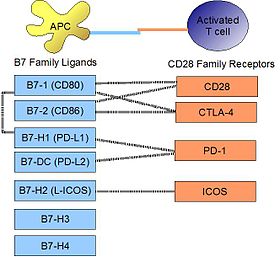
PD-L1 связывается со своим рецептором PD-1 , обнаруженным на активированных Т-клетках, В-клетках и миелоидных клетках, чтобы модулировать активацию или ингибирование. Сродство между PD-L1 и PD-1, определяемое константой диссоциации K d , составляет 770 нМ. PD-L1 также имеет заметное сродство к костимулирующей молекуле CD80 (B7-1), но не к CD86 (B7-2). Сродство CD80 к PD-L1, 1,4 мкМ, является промежуточным между его сродством к CD28 и CTLA-4 (4,0 мкМ и 400 нМ, соответственно). Родственная молекула PD-L2 не имеет такого сродства к CD80 или CD86, но разделяет PD-1 в качестве рецептора (с более сильным K d 140 нМ). Саид и др. показали, что PD-1, активированный на активированных Т-клетках CD4, может связываться с PD-L1, экспрессируемым на моноцитах, и индуцирует продукцию IL-10 последними.
Сигнализация
Взаимодействие PD-L1 с его рецептором PD-1 на Т-клетках дает сигнал, который ингибирует опосредованную TCR активацию продукции IL-2 и пролиферацию Т-клеток. Механизм включает ингибирование фосфорилирования ZAP70 и его ассоциации с CD3ζ . Передача сигналов PD-1 ослабляет фосфорилирование петли активации PKC-θ (в результате передачи сигналов TCR), необходимое для активации факторов транскрипции NF-κB и AP-1 , а также для продукции IL-2. Связывание PD-L1 с PD-1 также способствует индуцированной лигандом понижающей модуляции TCR во время презентации антигена наивным Т-клеткам, индуцируя повышающую регуляцию CBL-b убиквитинлигазы E3.
Регулирование
Интерферонами
После стимуляции IFN-γ PD-L1 экспрессируется на Т-клетках, NK-клетках, макрофагах, миелоидных DC, В-клетках, эпителиальных клетках и эндотелиальных клетках сосудов. Промоторная область гена PD-L1 имеет элемент ответа на IRF-1 , регуляторный фактор интерферона. Интерфероны типа I могут также активировать PD-L1 в гепатоцитах, моноцитах, DC и опухолевых клетках мышей.
На макрофаги и моноциты
PD-L1 заметно экспрессируется на макрофагах . На мышах было показано, что классически активированные макрофаги (индуцированные хелперными Т-клетками I типа или комбинацией ЛПС и гамма-интерферона ) значительно повышают регуляцию PD-L1. Альтернативно, макрофаги, активируемые IL-4 (альтернативные макрофаги), слегка повышают регуляцию PD-L1, в то же время значительно повышая регуляцию PD-L2. На мышах с дефицитом STAT1 было показано , что STAT1 в основном отвечает за активацию PD-L1 на макрофагах с помощью ЛПС или гамма-интерферона, но совсем не отвечает за его конститутивную экспрессию перед активацией у этих мышей. Было также показано, что PD-L1 постоянно экспрессируется на неклассических моноцитах Ly6C lo мыши в устойчивом состоянии.
Роль микроРНК
Покоящиеся холангиоциты человека экспрессируют мРНК PD-L1, но не белок, из-за подавления трансляции микроРНК miR-513. После обработки гамма-интерфероном, miR-513 подавлялась, тем самым снимая подавление белка PD-L1. Таким образом, гамма-интерферон может индуцировать экспрессию белка PD-L1 путем ингибирования опосредованного генами подавления трансляции мРНК. В то время как латентный мембранный белок-1 вируса Эпштейна-Барра (EBV) (LMP1) является известным мощным индуктором PD-L1, было показано, что фрагмент H miRNA miR-BamH1 EBV, открытая вправо рамка считывания 1 (BHRF1) 2-5p, может регулируют экспрессию PD-L1, индуцированную LMP1.
Эпигенетическая регуляция
Метилирование ДНК промотора PD-L1 может предсказать выживаемость при некоторых формах рака после операции.
Клиническое значение
Рак
Повышающая регуляция PD-L1 может позволить раку ускользнуть от иммунной системы хозяина. Анализ 196 образцов опухолей от пациентов с почечно-клеточной карциномой показал, что высокая экспрессия PD-L1 в опухоли была связана с повышенной агрессивностью опухоли и повышением риска смерти в 4,5 раза. Многие ингибиторы PD-L1 находятся в стадии разработки в качестве средств иммуноонкологической терапии и показывают хорошие результаты в клинических испытаниях. Клинически доступные примеры включают дурвалумаб , атезолизумаб и авелумаб . В нормальной ткани обратная связь между факторами транскрипции, такими как STAT3 и NF-κB, ограничивает иммунный ответ для защиты ткани хозяина и ограничения воспаления. При раке потеря обратной связи между факторами транскрипции может привести к повышенной локальной экспрессии PD-L1, что может ограничивать эффективность системного лечения агентами, нацеленными на PD-L1. CAR-T и NK- клетки, нацеленные на PD-L1, оцениваются для лечения рака.
Listeria monocytogenes
В мышиной модели внутриклеточной инфекции L. monocytogenes индуцировала экспрессию белка PD-L1 в Т-клетках, NK-клетках и макрофагах. Блокада PD-L1 (с использованием блокирующих антител) привела к увеличению смертности инфицированных мышей. Блокада уменьшала продукцию TNFα и оксида азота макрофагами, уменьшала продукцию гранзима B NK-клетками и уменьшала пролиферацию антиген-специфических CD8 T-клеток L. monocytogenes (но не CD4 T-клеток). Эти данные свидетельствуют о том, что PD-L1 действует как положительная костимулирующая молекула при внутриклеточной инфекции.
Аутоиммунитет
Взаимодействие PD-1 / PD-L1 вовлечено в аутоиммунитет по нескольким линиям доказательств. Было показано, что у мышей NOD , модели аутоиммунитета на животных, которые демонстрируют предрасположенность к спонтанному развитию диабета I типа и других аутоиммунных заболеваний, развивается ускоренное начало диабета из-за блокады PD-1 или PD-L1 (но не PD-L2). .
Было обнаружено, что у людей PD-L1 изменяет экспрессию у педиатрических пациентов с системной красной волчанкой (СКВ). Изучая изолированные PBMC от здоровых детей, незрелые миелоидные дендритные клетки и моноциты экспрессировали мало PD-L1 при первоначальном выделении, но спонтанно повышали уровень PD-L1 к 24 часам. Напротив, ни мДК, ни моноциты пациентов с активной СКВ не смогли активировать PD-L1 в течение 5-дневного курса, экспрессируя этот белок только во время ремиссии заболевания. Это может быть один из механизмов потери периферической толерантности при СКВ.
Смотрите также
использованная литература
внешние ссылки
- CD274 + белок, + человеческий по медицинским предметным рубрикам Национальной медицинской библиотеки США (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : Q9NZQ7 (лиганд 1 запрограммированной гибели клеток 1) в PDBe-KB .