Радий - Radium
 | |||||||||||||||||||||||||||||||
| Радий | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение |
/ Г eɪ д я ə м / ( RAY -dee-əm ) |
||||||||||||||||||||||||||||||
| Появление | серебристо-белый металлик | ||||||||||||||||||||||||||||||
| Массовое число | [226] | ||||||||||||||||||||||||||||||
| Радий в периодической таблице | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 88 | ||||||||||||||||||||||||||||||
| Группа | группа 2 (щелочноземельные металлы) | ||||||||||||||||||||||||||||||
| Период | период 7 | ||||||||||||||||||||||||||||||
| Блокировать | s-блок | ||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Rn ] 7s 2 | ||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 18, 32, 18, 8, 2 | ||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||
| Фаза на СТП | твердый | ||||||||||||||||||||||||||||||
| Температура плавления | 973 К (700 ° C, 1292 ° F) (оспаривается) | ||||||||||||||||||||||||||||||
| Точка кипения | 2010 К (1737 ° C, 3159 ° F) | ||||||||||||||||||||||||||||||
| Плотность (около rt ) | 5,5 г / см 3 | ||||||||||||||||||||||||||||||
| Теплота плавления | 8,5 кДж / моль | ||||||||||||||||||||||||||||||
| Теплота испарения | 113 кДж / моль | ||||||||||||||||||||||||||||||
Давление газа
| |||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||
| Состояния окисления | +2 (ожидается, что в нем будет сильно основной оксид) | ||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 0,9 | ||||||||||||||||||||||||||||||
| Энергии ионизации | |||||||||||||||||||||||||||||||
| Ковалентный радиус | 221 ± 14 часов | ||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 283 вечера | ||||||||||||||||||||||||||||||
| Спектральные линии радия | |||||||||||||||||||||||||||||||
| Прочие свойства | |||||||||||||||||||||||||||||||
| Естественное явление | от разложения | ||||||||||||||||||||||||||||||
| Кристальная структура | объемно-центрированной кубической (ОЦК) | ||||||||||||||||||||||||||||||
| Теплопроводность | 18,6 Вт / (м⋅K) | ||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 1 мкОм⋅м (при 20 ° C) | ||||||||||||||||||||||||||||||
| Магнитный заказ | немагнитный | ||||||||||||||||||||||||||||||
| Количество CAS | 7440-14-4 | ||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||
| Открытие | Пьер и Мария Кюри (1898) | ||||||||||||||||||||||||||||||
| Первая изоляция | Мария Кюри (1910) | ||||||||||||||||||||||||||||||
| Основные изотопы радия | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Радий является химическим элементом с символом Ra и атомным номером 88. Это шестой элемент в группе 2 в периодической таблице , также известной как щелочно - земельных металлы . Чистый радий серебристо-белый, но он легко реагирует с азотом (а не с кислородом) на воздухе, образуя черный поверхностный слой нитрида радия (Ra 3 N 2 ). Все изотопы радия очень радиоактивны , причем наиболее стабильным изотопом является радий-226 , период полураспада которого составляет 1600 лет и который распадается на газ радон (в частности, изотоп радон-222 ). Когда радий распадается, ионизирующее излучение является побочным продуктом, который может возбуждать флуоресцентные химические вещества и вызывать радиолюминесценцию .
Радий, в виде хлорида радия , был обнаружен с помощью Мари и Пьера Кюри в 1898 году из руды , добываемой на Яхимова . Они извлекли соединение радия из уранинита и пять дней спустя опубликовали открытие во Французской академии наук . Радий в металлическом состоянии был выделен Мари Кюри и Андре-Луи Дебьерном путем электролиза хлорида радия в 1911 году.
В природе радий содержится в урановых и (в меньшей степени) ториевых рудах в следовых количествах, составляющих всего одну седьмую грамма на тонну уранинита. Радий не является необходимым для живых организмов , и при его включении в биохимические процессы из-за его радиоактивности и химической активности возможны неблагоприятные последствия для здоровья. В настоящее время радий не имеет коммерческого применения , кроме его использования в ядерной медицине ; раньше он использовался в качестве радиоактивного источника для радиолюминесцентных устройств, а также в радиоактивном шарлатанстве из- за его предполагаемых целебных свойств. Сегодня эти прежние применения уже не в моде, потому что стала известна токсичность радия, и вместо этого в радиолюминесцентных устройствах используются менее опасные изотопы.
Объемные свойства
Радий - самый тяжелый из известных щелочноземельных металлов и единственный радиоактивный член своей группы. Его физические и химические свойства больше всего напоминают его более легкий родственный барий .
Чистый радий - летучий серебристо-белый металл, хотя его более легкие родственники - кальций , стронций и барий - имеют легкий желтый оттенок. Этот оттенок быстро исчезает на воздухе, образуя черный слой нитрида радия (Ra 3 N 2 ). Его температура плавления составляет 700 ° C (1292 ° F) или 960 ° C (1760 ° F), а температура кипения составляет 1737 ° C (3159 ° F). Оба эти значения немного ниже, чем у бария, что подтверждает периодические тенденции вниз по элементам группы 2. Подобно барию и щелочным металлам , радий кристаллизуется в объемно -центрированной кубической структуре при стандартных температуре и давлении : расстояние связи радий-радий составляет 514,8 пикометра . Радий имеет плотность 5,5 г / см 3 , что выше, чем у бария, что еще раз подтверждает периодические тенденции; отношение плотностей радия и бария сравнимо с отношением атомных масс радия и бария из-за схожести кристаллических структур двух элементов.
Изотопы
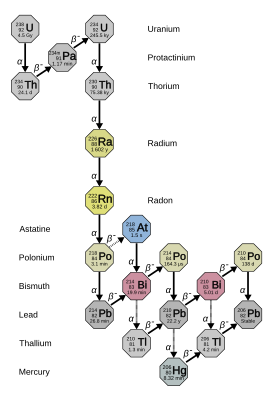
Радий имеет 33 известных изотопа с массовыми числами от 202 до 234: все они радиоактивны . Четыре из них - 223 Ra ( период полураспада 11,4 дня), 224 Ra (3,64 дня), 226 Ra (1600 лет) и 228 Ra (5,75 года) - естественным образом встречаются в цепочках распада первичного тория- 232, урана- 235 и уран-238 ( 223 Ra из урана-235, 226 Ra из урана-238 и два других из тория-232). Тем не менее, эти изотопы имеют слишком короткий период полураспада, чтобы быть первичными радионуклидами, и существуют в природе только из этих цепочек распада. Вместе с в основном искусственным 225 Ra (15 d), который встречается в природе только как продукт распада мельчайших следов 237 Np, это пять самых стабильных изотопов радия. Все другие известные изотопы радия имеют период полураспада менее двух часов, а большинство из них имеет период полураспада менее минуты. Сообщалось по крайней мере о 12 ядерных изомерах ; наиболее стабильным из них является радий-205m с периодом полураспада от 130 до 230 миллисекунд; это все еще меньше, чем двадцать четыре изотопа радия в основном состоянии .
На раннем этапе изучения радиоактивности различным природным изотопам радия давали разные названия. На этой схеме 223 Ra был назван актинием X (AcX), 224 Ra торием X (ThX), 226 Ra радием (Ra) и 228 Ra мезоторием 1 (MsTh 1 ). Когда стало понятно, что все это изотопы одного и того же элемента, многие из этих названий вышли из употребления, и «радий» стал обозначать все изотопы, а не только 226 Ra. Некоторые продукты распада радия-226 получили исторические названия, включая «радий», в диапазоне от радия A до радия G, с буквой, указывающей приблизительно, как далеко они были вниз по цепочке от своего родительского 226 Ra. Эмиссия радия = 222 Rn, RaA = 218 Po, RaB = 214 Pb, RaC = 214 Bi, RaC 1 = 214 Po, RaC 2 = 210 Tl, RaD = 210 Pb, RaE = 210 Bi, RaF = 210 Po и RaG = 206 Pb.
226 Ra является наиболее стабильным изотопом радия и последним изотопом в цепи распада (4 n + 2) урана-238 с периодом полураспада более тысячелетия: он составляет почти весь природный радий. Его непосредственным продуктом распада является плотный радиоактивный благородный газ радон (в частности, изотоп 222 Rn ), который несет ответственность за большую часть опасности радия в окружающей среде. Он в 2,7 миллиона раз более радиоактивен, чем такое же молярное количество природного урана (в основном урана-238), из-за его пропорционально более короткого периода полураспада.
Образец металлического радия поддерживает более высокую температуру, чем окружающая его среда, из-за испускаемого им излучения - альфа-частиц , бета-частиц и гамма-лучей . Более конкретно, природный радий (который в основном состоит из 226 Ra) испускает в основном альфа-частицы, но другие этапы его цепочки распада ( ряд урана или радия ) испускают альфа- или бета-частицы, и почти все выбросы частиц сопровождаются гамма-лучами.
В 2013 году было обнаружено, что ядро радия-224 имеет грушевидную форму. Это было первое открытие асимметричного ядра.
Химия
Радий, как барий, является высоко реакционноспособным металлом и всегда проявляет свою группу окисления состояние +2. Он образует бесцветный катион Ra 2+ в водном растворе , который является очень основным и не образует легко комплексов . Таким образом, большинство соединений радия являются простыми ионными соединениями, хотя ожидается участие 6s- и 6p-электронов (в дополнение к валентным 7s-электронам) из-за релятивистских эффектов, которые могут усилить ковалентный характер соединений радия, таких как Ra F 2 и Ra At 2. . По этой причине стандартный электродный потенциал для полуреакции Ra 2+ (aq) + 2e - → Ra (s) составляет −2,916 В , что даже немного ниже, чем значение −2,92 В для бария, тогда как ранее значения были плавными. увеличивается вниз по группе (Ca: -2,84 В; Sr: -2,89 В; Ba: -2,92 В). Значения для бария и радия почти такие же, как и для более тяжелых щелочных металлов - калия , рубидия и цезия .
Соединения
Твердые соединения радия имеют белый цвет, поскольку ионы радия не придают особой окраски, но со временем они постепенно желтеют, а затем темнеют из-за саморадиолиза в результате альфа-распада радия . Нерастворимые соединения радия осаждаются совместно со всем барием, большинством стронция и большинством соединений свинца .
Оксид радия (RaO) не был охарактеризован давно, несмотря на то, что оксиды являются обычными соединениями для других щелочноземельных металлов. Гидроксид радия (Ra (OH) 2 ) является наиболее легко растворимым среди гидроксидов щелочноземельных металлов и является более сильным основанием, чем его родственный барий родственный ему гидроксид бария . Кроме того , более растворимы , чем гидроксид актиния и тория гидроксида : эти три смежных гидроксиды , могут быть разделены путем осаждения их с аммиаком .
Хлорид радия (RaCl 2 ) - бесцветное светящееся соединение. Через некоторое время он становится желтым из-за саморазрушения альфа-излучением радия при распаде. Небольшие примеси бария придают соединению розовый цвет. Он растворим в воде, хотя и в меньшей степени, чем хлорид бария , и его растворимость уменьшается с увеличением концентрации соляной кислоты . Кристаллизация из водного раствора дает дигидрат RaCl 2 · 2H 2 O, изоморфный своему бариевому аналогу.
Бромид радия (RaBr 2 ) также представляет собой бесцветное светящееся соединение. В воде он более растворим, чем хлорид радия. Как и хлорид радия, кристаллизация из водного раствора дает дигидрат RaBr 2 · 2H 2 O, изоморфный своему аналогу бария. Ионизирующее излучение, испускаемое бромидом радия, возбуждает в воздухе молекулы азота , заставляя его светиться. Эти альфа - частицы , испускаемые радием быстро получить два электрона , чтобы стать нейтрального гелия , который накапливается внутри и ослабляет кристаллы радий бромид. Этот эффект иногда приводит к тому, что кристаллы ломаются или даже взрываются.
Нитрат радия (Ra (NO 3 ) 2 ) - белое соединение, которое можно получить путем растворения карбоната радия в азотной кислоте . По мере увеличения концентрации азотной кислоты растворимость нитрата радия уменьшается, что является важным свойством для химической очистки радия.
Радий форма почти таким же нерастворимые соли , как его более легкий конгенеры барий: он образует нерастворимый сульфат (РАСА 4 , наиболее нерастворимый известный сульфат), хромат (RaCrO 4 ), карбонат (Racó 3 ), йодат (Ра (IO 3 ) 2 ) , тетрафторобериллат (RaBeF 4 ) и нитрат (Ra (NO 3 ) 2 ). За исключением карбоната, все они менее растворимы в воде, чем соответствующие соли бария, но все они изоструктурны своим аналогам бария. Кроме того, фосфат , оксалат и сульфит радия , вероятно, также нерастворимы, поскольку они совместно осаждаются с соответствующими нерастворимыми солями бария. Высокая нерастворимость сульфата радия (при 20 ° C только 2,1 мг растворяется в 1 кг воды) означает, что это одно из менее биологически опасных соединений радия. Большой ионный радиус Ra 2+ (148 мкм) приводит к слабому комплексообразованию и плохому извлечению радия из водных растворов, когда не при высоких значениях pH.
Вхождение
Все изотопы радия имеют период полураспада намного короче возраста Земли , так что любой первичный радий давно бы распался. Тем не менее, радий все еще присутствует в окружающей среде , поскольку изотопы 223 Ra, 224 Ra, 226 Ra и 228 Ra являются частью цепочек распада природных изотопов тория и урана; поскольку торий и уран имеют очень длительный период полураспада, эти дочери постоянно регенерируются в результате их распада. Из этих четырех изотопов самым долгоживущим является 226 Ra (период полураспада 1600 лет), продукт распада природного урана. Из-за своей относительной долговечности 226 Ra является наиболее распространенным изотопом этого элемента, составляя примерно одну часть на триллион земной коры; практически весь природный радий составляет 226 Ra. Таким образом, радий содержится в крошечных количествах в урановой руде уранинита и различных других урановых минералах , а еще меньшие количества - в минералах тория. Одна тонна из урановой руды , как правило , дает около одной седьмой в грамм радия. Один килограмма в земной коре содержится около 900 пкгов радия, и один литр из морской воды содержит около 89 femtograms радия.
История

Радий был обнаружен на Мари Склодовской-Кюри и ее муж Пьер Кюри 21 декабря 1898 года, в уранинита (настурановые) образца из Яхимов . Изучая минерал ранее, Кюри удалили из него уран и обнаружили, что оставшийся материал все еще радиоактивен. В июле 1898 г., изучая уран, они выделили элемент, похожий на висмут, который оказался полонием . Затем они выделили радиоактивную смесь, состоящую в основном из двух компонентов: соединений бария , которые давали ярко-зеленый цвет пламени, и неизвестных радиоактивных соединений, которые давали карминовые спектральные линии , которые никогда не были зарегистрированы ранее. Кюри обнаружили, что радиоактивные соединения очень похожи на соединения бария, за исключением того, что они менее растворимы. Это позволило семье Кюри выделить радиоактивные соединения и открыть в них новый элемент. Кюри объявили о своем открытии Французской академии наук 26 декабря 1898 года. Название радия датируется примерно 1899 годом от французского слова radium , образованного в современной латыни от радиуса ( луча ): это было признание способности радия излучать энергия в виде лучей.
В сентябре 1910 года Мария Кюри и Андре-Луи Дебьерн объявили, что они выделили радий как чистый металл путем электролиза раствора чистого хлорида радия (RaCl 2 ) с использованием ртутного катода , в результате чего была получена радий-ртутная амальгама . Затем эту амальгаму нагревали в атмосфере газообразного водорода, чтобы удалить ртуть, оставив чистый металлический радий. Позднее в том же году Э. Эолер выделил радий термическим разложением его азида Ra (N 3 ) 2 . Металлический радий был впервые промышленно произведен в начале 20 века компанией Biraco , дочерней компанией Union Minière du Haut Katanga (UMHK) на ее заводе в Олене в Бельгии.
Общая историческая единица радиоактивности, кюри , основана на радиоактивности 226 Ra.
Исторические приложения
Люминесцентная краска
Радий раньше использовался в самосветящихся красках для часов, ядерных панелей, переключателей самолетов, часов и циферблатов приборов. Типичные самосветящиеся часы, в которых используется радиевая краска, содержат около 1 микрограмма радия. В середине 1920-х годов против Radium Corporation в Соединенных Штатах был подан иск пятью умирающими « Radium Girls » - художниками по циферблатам, которые нарисовали люминесцентную краску на основе радия на циферблатах наручных часов. Мастера по рисованию циферблатов были проинструктированы лизать свои кисти, чтобы придать им тонкий острие, тем самым проглатывая радий. Их воздействие радия вызвало серьезные последствия для здоровья, включая язвы, анемию и рак костей . Это связано с тем, что организм воспринимает радий как кальций и откладывает его в костях , где радиоактивность разрушает костный мозг и может мутировать костные клетки .
В ходе судебного разбирательства было установлено, что ученые и руководство компании приняли значительные меры предосторожности, чтобы защитить себя от воздействия радиации, но не сочли нужным защитить своих сотрудников. Кроме того, в течение нескольких лет компании пытались скрыть последствия и избежать ответственности, настаивая на том, что Radium Girls вместо этого страдают сифилисом . Это полное пренебрежение благосостоянием сотрудников оказало значительное влияние на формулировку трудового законодательства о профессиональных заболеваниях .
В результате судебного процесса о вредных последствиях радиоактивности стало широко известно, и маляры с радиевыми циферблатами были проинструктированы о надлежащих мерах предосторожности и обеспечены защитным снаряжением. В частности, мастера по рисованию циферблатов больше не облизывали кисти, чтобы придать им форму (что вызвало попадание солей радия в организм). Радий все еще использовался в циферблатах вплоть до 1960-х годов, но художники по циферблатам больше не пострадали. Это подчеркивало, что вреда для Radium Girls можно было легко избежать.
С 1960-х годов использование радиевой краски было прекращено. Во многих случаях светящиеся циферблаты были выполнены из нерадиоактивных флуоресцентных материалов, возбуждаемых светом; такие устройства светятся в темноте после воздействия света, но свечение тускнеет. Там, где требовалось длительное самосветление в темноте, использовалась более безопасная радиоактивная краска прометий- 147 (период полураспада 2,6 года) или тритий (период полураспада 12 лет); оба продолжают использоваться сегодня. У них было дополнительное преимущество, заключающееся в том, что люминофор не ухудшался со временем, в отличие от радия. Тритий испускает бета-излучение очень низкой энергии (даже с меньшей энергией, чем бета-излучение, испускаемое прометием), которое не может проникнуть через кожу, а не проникающее гамма-излучение радия, и считается более безопасным.
Часы, часы и инструменты, датируемые первой половиной 20-го века, часто используемые в военных целях, могли быть окрашены радиоактивной светящейся краской. Обычно они больше не светятся; однако это происходит не из-за радиоактивного распада радия (период полураспада которого составляет 1600 лет), а из-за износа флуоресцентной среды сульфида цинка под действием излучения радия. Появление часто толстого слоя зеленой или желтовато-коричневой краски на устройствах этого периода указывает на радиоактивную опасность. Доза облучения от неповрежденного устройства относительно невелика и обычно не представляет острого риска; но краска опасна при утечке, вдыхании или проглатывании.
Коммерческое использование
Когда-то радий был добавкой в такие продукты, как зубная паста, кремы для волос и даже продукты питания из-за его предполагаемых целебных свойств. Такие продукты вскоре вышли из моды и были запрещены властями многих стран после того, как было обнаружено, что они могут иметь серьезные неблагоприятные последствия для здоровья. (См, например, Radithor или Revigator типы «радий воды» или «Standard Radium Solution для питья».) СПА с участием радий-богатых воды , которые до сих пор иногда рекламируемый как полезно, например, в Мисаса, Тоттори , Япония. В США с конца 1940-х до начала 1970-х годов детям назальное облучение радием также применялось для предотвращения проблем со средним ухом или увеличения миндалин.
Медицинское использование
Радий (обычно в форме хлорида радия или бромида радия ) использовался в медицине для производства газообразного радона, который, в свою очередь, использовался для лечения рака ; например, некоторые из этих источников радона использовались в Канаде в 1920-х и 1930-х годах. Однако многие методы лечения, которые использовались в начале 1900-х годов, больше не используются из-за вредного воздействия, вызванного воздействием бромида радия. Некоторые примеры этих эффектов - анемия , рак и генетические мутации . Более безопасные гамма-излучатели, такие как 60 Co , который является менее дорогостоящим и доступен в больших количествах, сегодня обычно используются для замены радия, ранее использовавшегося в этом приложении.
В начале 1900-х годов биологи использовали радий для индукции мутаций и изучения генетики . Еще в 1904 году Дэниел МакДугал использовал радий в попытке определить, может ли он спровоцировать внезапные большие мутации и вызвать серьезные эволюционные сдвиги. Томас Хант Морган использовал радий, чтобы вызвать изменения, приводящие к появлению белоглазых плодовых мушек. Нобелевский лауреат, биолог Герман Мюллер вкратце изучил влияние радия на мутации плодовых мух, прежде чем перейти к более доступным рентгеновским экспериментам.
Говард Этвуд Келли , один из врачей-основателей больницы Джона Хопкинса , был одним из пионеров использования радия в медицине для лечения рака. Его первым пациентом была его собственная тетя в 1904 году, которая умерла вскоре после операции. Известно, что Келли использовала чрезмерное количество радия для лечения различных видов рака и опухолей. В результате некоторые из его пациентов умерли от облучения радием. Его метод применения радия заключался в введении капсулы с радием рядом с пораженным участком, а затем пришивании радиевых «точек» непосредственно к опухоли . Это был тот же метод , используемый для лечения Генриетта Лакс , хозяин исходных клеток HeLa , для рака шейки матки . В настоящее время вместо них используются более безопасные и доступные радиоизотопы.
Производство

В конце 19 века уран не применялся в больших масштабах, поэтому крупных урановых рудников не существовало. Вначале единственным крупным источником урановой руды были серебряные рудники в Яхимове , Австро-Венгрия (ныне Чехия ). Урановая руда была лишь побочным продуктом добычи полезных ископаемых.
При первом извлечении радия Кюри использовал остатки после извлечения урана из урана. Уран был извлечен растворением в серной кислоте с образованием сульфата радия, который похож на сульфат бария, но еще менее растворим в остатках. Остатки также содержали довольно значительные количества сульфата бария, который, таким образом, действовал как носитель для сульфата радия. Первые шаги процесса извлечения радия включали кипячение с гидроксидом натрия с последующей обработкой соляной кислотой для минимизации примесей других соединений. Оставшийся остаток затем обрабатывали карбонатом натрия, чтобы превратить сульфат бария в карбонат бария (несущий радий), таким образом сделав его растворимым в соляной кислоте. После растворения барий и радий переосаждены в виде сульфатов; затем это повторяли для дополнительной очистки смешанного сульфата. Некоторые примеси, образующие нерастворимые сульфиды, удаляли обработкой раствора хлорида сероводородом с последующей фильтрацией. Когда смешанные сульфаты стали достаточно чистыми, их снова превратили в смешанные хлориды; После этого барий и радий были разделены путем фракционной кристаллизации , наблюдая за процессом с помощью спектроскопа (радий дает характерные красные линии в отличие от зеленых линий бария) и электроскопа .
После выделения радия Мари и Пьером Кюри из урановой руды в Иоахимстале несколько ученых начали выделять радий в небольших количествах. Позже небольшие компании приобрели хвосты рудников Иоахимстала и начали выделять радий. В 1904 году австрийское правительство национализировало шахты и прекратило экспорт сырой руды. Некоторое время доступность радия была низкой.
Формирование австрийской монополии и сильное стремление других стран получить доступ к радию привели к поиску урановых руд во всем мире. Соединенные Штаты стали ведущим производителем в начале 1910-х годов. В карнотите пески в Колорадо обеспечивают некоторые из элементов, но более богатые руды находятся в Конго и районе Большого Медвежьего озера и Невольничье озеро на северо - запад Канады. Ни одно из месторождений не добывает радий, но содержание урана делает добычу прибыльной.
Процесс Кюри все еще использовался для промышленного извлечения радия в 1940 году, но затем для фракционирования использовались смешанные бромиды. Если содержание бария в урановой руде недостаточно высоко, легко добавить немного для переноса радия. Эти процессы применялись к рудам с высоким содержанием урана, но могут не работать с рудами с низким содержанием.
Небольшие количества радия все еще извлекались из урановой руды этим методом смешанного осаждения и ионного обмена еще в 1990-х годах, но сегодня его извлекают только из отработавшего ядерного топлива. В 1954 году общие мировые поставки очищенного радия составляли около 5 фунтов (2,3 кг), и они все еще находятся в этом диапазоне сегодня, в то время как годовое производство чистых соединений радия в настоящее время составляет всего около 100 г. Основными странами-производителями радия являются Бельгия, Канада, Чехия, Словакия , Великобритания и Россия . Количество произведенного радия было и остается относительно небольшим; например, в 1918 году в США было произведено 13,6 г радия. Металл выделяют восстановлением оксида радия металлическим алюминием в вакууме при 1200 ° C.
Современные приложения
Исследования в области атомной, молекулярной и оптической физики
Радий находит все большее применение в области атомной, молекулярной и оптической физики . Силы нарушения симметрии масштабируются пропорционально , что делает радий, самый тяжелый щелочноземельный элемент, хорошо подходящим для ограничения новой физики, выходящей за рамки стандартной модели. Некоторые изотопы радия, такие как радий-225, имеют октупольные деформированные дублеты четности, которые повышают чувствительность к зарядовой четности, нарушая новую физику, на два-три порядка по сравнению с Hg.
Радий также перспективен для изготовления оптических часов с ловушками на ионах . Ион радия имеет два перехода с субгерцовой шириной линии из основного состояния, которые могут служить часовым переходом в оптических часах. Кроме того, радий может быть особенно хорошо подходящим для переносных оптических часов, поскольку все переходы, необходимые для работы часов, могут быть адресованы с помощью прямых диодных лазеров.
Хотя у радия нет стабильных изотопов, существует одиннадцать изотопов радия с периодом полураспада более одной минуты, что можно сравнить с высокой точностью на графике Кинга. Изотопные сдвиги могут быть измерены с высокой точностью на любом из радия ионных subhertz-переходов от ширины линии основного состояния, или на к интеркомбинационной линии в нейтральном радии. Степень любой потенциальной нелинейности в таком сюжете Кинга может установить границы для новой физики, выходящей за рамки стандартной модели.
Некоторые из немногих практических применений радия связаны с его радиоактивными свойствами. Недавно открытые радиоизотопы , такие как кобальт-60 и цезий-137 , заменяют радий даже в этих ограниченных областях применения, потому что некоторые из этих изотопов являются более мощными излучателями, более безопасными в обращении и доступны в более концентрированной форме.
Изотоп 223 Ra (под торговым названием Xofigo ) был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в 2013 году для использования в медицине для лечения рака при метастазах в кости . Основным показанием к лечению Ксофиго является терапия костных метастазов от кастрационно-резистентного рака простаты из-за благоприятных характеристик этого радиофармпрепарата с альфа-излучателем. 225 Ra также использовался в экспериментах по терапевтическому облучению, поскольку это единственный достаточно долгоживущий изотоп радия, у которого нет радона в качестве одной из дочерей.
Радий до сих пор используется в качестве источника излучения в некоторых промышленных радиографических устройствах для проверки металлических деталей на наличие дефектов, аналогично рентгеновской визуализации . При смешивании с бериллием радий действует как источник нейтронов . Радий-бериллиевые источники нейтронов иногда используются даже сегодня, но сейчас более распространены другие материалы, такие как полоний : в России ежегодно используется около 1500 полоний-бериллиевых источников нейтронов с индивидуальной активностью 1850 Ки (68 ТБк) . Эти источники нейтронов на основе RaBeF 4 (α, n) устарели, несмотря на большое количество нейтронов, которые они излучают (1,84 × 10 6 нейтронов в секунду), в пользу источников 241 Am- Be. Сегодня изотоп 226 Ra в основном используется для образования 227 Ac путем нейтронного облучения в ядерном реакторе.
Опасности
Радий очень радиоактивен, и его непосредственный дочерний элемент , радон , также радиоактивен. При проглатывании 80% попавшего внутрь радия покидает организм с калом , а остальные 20% попадают в кровоток , в основном накапливаясь в костях. Воздействие радия, внутреннего или внешнего, может вызвать рак и другие расстройства, потому что радий и радон при распаде испускают альфа- и гамма-лучи , которые убивают и видоизменяют клетки. Во время Манхэттенского проекта в 1944 году «допустимая доза» для рабочих была установлена на уровне 0,1 микрограмма принятого внутрь радия.
Некоторые из биологических эффектов радия включают первый случай «радиевого дерматита», зарегистрированный в 1900 году, через два года после открытия этого элемента. Французский физик Антуан Беккерель шесть часов носил в жилетном кармане маленькую ампулу с радием и сообщил, что на его коже появились изъязвления . Пьер и Мария Кюри были настолько заинтригованы радиацией, что пожертвовали собственным здоровьем, чтобы узнать о ней больше. Пьер Кюри прикрепил к руке трубку, наполненную радием, на десять часов, что привело к появлению кожного поражения, что наводит на мысль об использовании радия для поражения раковых тканей, так как он поражал здоровые ткани. Обращение с радием было обвинено в смерти Марии Кюри из-за апластической анемии . Значительную опасность радий представляет его дочерний радон: будучи газом, он может проникать в организм гораздо легче, чем его родительский радий.
Сегодня 226 Ra считается наиболее токсичным из количества радиоэлементов, и с ним необходимо работать в плотных перчаточных боксах со значительной циркуляцией воздушного потока, который затем обрабатывается, чтобы избежать утечки его дочернего 222 Rn в окружающую среду. Старые ампулы, содержащие растворы радия, необходимо открывать с осторожностью, поскольку радиолитическое разложение воды может вызвать избыточное давление газообразного водорода и кислорода. Самая большая в мире концентрация 226 Ra хранится во временной структуре содержания отходов , примерно в 9,6 мили (15,4 км) к северу от Ниагарского водопада, штат Нью-Йорк .
Смотрите также
Примечания
использованная литература
Библиография
- Кирби, HW; Салуцкий, Мюррелл Л. (1964). Радиохимия радия (PDF) . Национальная академия прессы.
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
дальнейшее чтение
- Альберт Ствертка (1998). Путеводитель по элементам - переработанное издание . Издательство Оксфордского университета. ISBN 978-0-19-508083-4.
- Дениз Грейди (6 октября 1998 г.). «Сияние в темноте и урок научной опасности» . Нью-Йорк Таймс . Проверено 25 декабря 2007 года .
- Няня Фроман (1 декабря 1996 г.). «Мария и Пьер Кюри и открытие полония и радия» . Нобелевский фонд . Проверено 25 декабря 2007 года .
- Macklis, RM (1993). «Большой радиевый скандал». Scientific American . 269 (2): 94–99. Bibcode : 1993SciAm.269b..94M . DOI : 10.1038 / Scientificamerican0893-94 . PMID 8351514 .
- Кларк, Клаудия (1987). Радиевые девушки: женщины и реформа промышленного здравоохранения, 1910–1935 гг . Пресса Университета Северной Каролины. ISBN 978-0-8078-4640-7.
- Мария Кюри (1921), Открытие радия (1-е изд.), Покипси: Колледж Вассара , Wikidata Q22920166
внешние ссылки
- «Поперечная наука: открытие радия» . 8 июля 2012 года Архивировано из оригинала 9 марта 2016 года . Дата обращения 13 мая 2017 .
- Фото Радиевой водяной бани в Оклахоме
- Банк данных опасных веществ NLM - Радий, радиоактивный
- Аннотированная библиография по радию из Цифровой библиотеки по ядерным вопросам Алсоса, архивная 25 июня 2019 г. на Wayback Machine
- Радий в Периодической таблице видео (Ноттингемский университет)











