Канал транзиторного рецепторного потенциала - Transient receptor potential channel
| Ионный канал переходного рецепторного потенциала (TRP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Условное обозначение | ГТО | ||||||||
| Pfam | PF06011 | ||||||||
| ИнтерПро | IPR013555 | ||||||||
| OPM суперсемейство | 8 | ||||||||
| Белок OPM | 3j5p | ||||||||
| Мембранома | 605 | ||||||||
| |||||||||
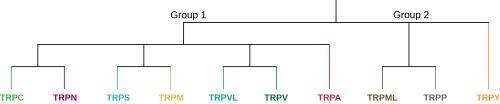
Каналы транзиторного рецепторного потенциала ( TRP-каналы ) представляют собой группу ионных каналов, расположенных в основном на плазматической мембране многих типов клеток животных. Большинство из них сгруппированы в две широкие группы: Группа 1 включает TRPC («C» для канонического), TRPV («V» для ваниллоидного), TRPVL («VL» для ваниллоидоподобного), TRPM («M» для меластатина). , TRPS («S» для соромеластатина), TRPN («N» для отсутствия механорецепторного потенциала C) и TRPA («A» для анкирина). Группа 2 состоит из TRPP («P» для поликистоза) и TRPML («ML» для муколипина). Существуют и другие менее категоризованные каналы TRP, включая дрожжевые каналы и ряд каналов Группы 1 и Группы 2, присутствующих у неживотных. Многие из этих каналов передают различные ощущения, такие как боль, температура, различные вкусы, давление и зрение. Считается, что в организме некоторые каналы TRP ведут себя как микроскопические термометры и используются у животных для определения тепла или холода. Некоторые каналы TRP активируются молекулами, содержащимися в специях, таких как чеснок ( аллицин ), перец чили ( капсаицин ), васаби ( аллилизотиоцианат ); другие активируются ментолом , камфорой , мятой и охлаждающими агентами; а другие активируются молекулами каннабиса (например, THC , CBD и CBN ) или стевии . Некоторые действуют как датчики осмотического давления, объема, растяжения и вибрации. Большинство каналов активируются или ингибируются сигнальными липидами и вносят вклад в семейство липид-зависимых ионных каналов .
Эти ионные каналы обладают относительно неселективной проницаемостью для катионов , включая натрий , кальций и магний .
Каналы TRP были первоначально обнаружены в так называемом мутантном штамме «временного рецепторного потенциала» ( trp- мутант) плодовой мушки Drosophila , отсюда и их название (см. « Историю TRP каналов дрозофилы» ниже). Позднее TRP-каналы были обнаружены у позвоночных, где они повсеместно экспрессируются во многих типах клеток и тканях. Большинство TRP-каналов состоят из 6 проникающих через мембрану спиралей с внутриклеточными N- и C-концами . TRP-каналы млекопитающих активируются и регулируются широким спектром стимулов и выражаются по всему телу.
Семьи
В суперсемействе животных TRP в настоящее время предлагается 9 семейств, разделенных на две группы, каждая из которых содержит несколько подсемейств. Первая группа состоит из TRPC, TRPV, TRPVL, TRPA, TRPM, TRPS и TRPN, а вторая группа содержит TRPP и TRPML. Существует дополнительное семейство, обозначенное TRPY, которое не всегда входит ни в одну из этих групп. Все эти подсемейства схожи в том, что они представляют собой неселективные катионные каналы, воспринимающие молекулы, которые имеют шесть трансмембранных сегментов, однако каждое подсемейство очень уникально и имеет небольшую структурную гомологию друг с другом. Эта уникальность дает начало различным функциям сенсорного восприятия и регуляции, которые TRP-каналы выполняют по всему телу. Группа 1 и группа 2 различаются тем, что и TRPP, и TRPML группы 2 имеют гораздо более длинную внеклеточную петлю между трансмембранными сегментами S1 и S2. Другой отличительной особенностью является то, что все подсемейства группы 1 содержат либо С-концевую последовательность внутриклеточного анкиринового повтора, либо последовательность N-концевого домена TRP, либо и то, и другое, тогда как обе подсемейства группы 2 не имеют ни того, ни другого. Ниже приведены члены подсемейств и краткое описание каждого из них:
TRPA
| Семья | Подсемейство | Известные таксоны |
|---|---|---|
| TRPA | TRPA1 | Позвоночные , членистоногие и моллюски |
| TRPA-подобный | Хоанофлагелляты , книдарии , нематоды , членистоногие (только ракообразные и многоножки), моллюски и иглокожие | |
| TRPA5 | Членистоногие (только ракообразные и насекомые) | |
| безболезненный | ||
| гипертермия | ||
| водяная ведьма | ||
| HsTRPA | Специфические для перепончатокрылых насекомых |
TRPA, A от «анкирин», назван в честь большого количества анкириновых повторов, обнаруженных около N-конца. TRPA в первую очередь обнаруживается в афферентных ноцицептивных нервных волокнах и связан с усилением болевых сигналов, а также с гиперчувствительностью к холоду. Было показано, что эти каналы являются как механическими рецепторами боли, так и хемосенсорами, активируемыми различными химическими веществами, включая изотиоцианаты (едкие химические вещества в таких веществах, как горчичное масло и васаби), каннабиноиды, общие и местные анальгетики и коричный альдегид.
Хотя TRPA1 экспрессируется у большого количества животных, множество других каналов TRPA существует за пределами позвоночных. TRPA5, безболезненный, гипертермия и водяная вспышка являются отдельными филогенетическими ветвями внутри клады TRPA, и, как доказано, экспрессируется только у ракообразных и насекомых, в то время как HsTRPA возникла как специфическая для перепончатокрылых дупликация водяного переключателя. Подобно TRPA1 и другим каналам TRP, они функционируют как ионные каналы в ряде сенсорных систем. TRPA- или TRPA1-подобные каналы также существуют у множества видов в виде филогенетически отличной клады, но они менее изучены.
TRPC
| Семья | Подсемейство | Известные таксоны |
|---|---|---|
| TRPC | TRPC1 | Позвоночные |
| TRPC2 | ||
| TRPC3 | ||
| TRPC4 | ||
| TRPC5 | ||
| TRPC6 | ||
| TRPC7 | ||
| ГТО | Членистоногие | |
| TRPgamma | ||
| TRPL | ||
| Неизвестный | Хоанофлагелляты, книдарии, ксенакоеломорфы , лофотрохозойцы и нематоды |
TRPC, C означает «канонический», назван так, как наиболее тесно связанный с дрозофилией TRP, тезкой каналов TRP. Филогения каналов TRPC не была решена подробно, но они присутствуют во всех таксонах животных. Фактически существует только шесть каналов TRPC, экспрессируемых у людей, потому что TRPC2, как обнаружено, экспрессируется только у мышей и считается псевдогеном у людей; Отчасти это связано с ролью TRPC2 в обнаружении феромонов, способность которых у мышей повышена по сравнению с людьми. Мутации в каналах TRPC были связаны с респираторными заболеваниями наряду с фокальным сегментарным гломерулосклерозом в почках. Все каналы TRPC активируются либо фосфолипазой C (PLC), либо диациглицерином (DAG).
TRPM
| Семья | Подсемейство | Известные таксоны |
|---|---|---|
| TRPM | Alpha / α (включая TRPM1, 3, 6 и 7) | Хоанофлагелляты и животные (кроме тихоходок ) |
| Бета / β (включая TRPM2, 4, 5 и 8) |
TRPM, M для «меластатина», был обнаружен в ходе сравнительного генетического анализа доброкачественных невусов и злокачественных невусов (меланомы). Мутации в каналах TRPM были связаны с гипомагниемией с вторичной гипокальциемией. Каналы TRPM также стали известны своими механизмами измерения холода, например, TRPM8. Сравнительные исследования показали, что функциональные домены и важные аминокислоты каналов TRPM высоко консервативны у разных видов.
Филогенетика показала, что каналы TRPM делятся на две основные клады, αTRPM и βTRPM. αTRPM включают TRPM1, TRPM3 позвоночных и «шанзимы» TRPM6 и TRPM7, а также единственный канал TRPM насекомых, среди прочего. βTRPM включают, но не ограничиваются ими, TRPM2, TRPM4, TRPM5 и TRPM8 позвоночных (датчик холода и ментола). Были описаны две дополнительные основные клады: TRPMc, которая присутствует только у множества членистоногих, и базальная клада, которая с тех пор была предложена как отдельное и отдельное семейство TRP-каналов (TRPS).
TRPML
| Семья | Подсемейство | Известные таксоны |
|---|---|---|
| TRPML | Неизвестный | Нематоцистовые, базальные позвоночные, оболочники , cephalochordates , полухордовых , иглокожие, членистоногие и нематоды |
| TRPML1 | Специально для челюстных позвоночных | |
| TRPML2 | ||
| TRPML3 |
TRPML, ML от «муколипин», получил свое название от муколипидоза IV, связанного с нарушением развития нервной системы . Муколипидоз IV был впервые обнаружен в 1974 г. Э. Р. Берманом, который заметил аномалии в глазах младенца. Эти аномалии вскоре стали ассоциироваться с мутациями гена MCOLN1, который кодирует ионный канал TRPML1. TRPML все еще недостаточно охарактеризован. Три известные копии позвоночных ограничены челюстными позвоночными, за некоторыми исключениями (например, Xenopus tropicalis ).
TRPN
| Семья | Подсемейство | Известные таксоны |
|---|---|---|
| TRPN | TRPN / nompC | Плакозои, книдарии, нематоды, членистоногие, моллюски, кольчатые червецы и позвоночные (за исключением амниот) |
TRPN был первоначально описан у Drosophila melanogaster и Caenorhabditis elegans как nompC, механически управляемый ионный канал. Известно, что только один TRPN, N для «отсутствия механорецепторного потенциала C» или «nompC», широко экспрессируется у животных (хотя у некоторых книдарийцев их больше), и, в частности, является только псевдогеном у амниот позвоночных. Несмотря на TRPA быть назван в честь анкириновых повторами, TRPN каналы , как полагают, большинство из любого TRP канала, как правило , около 28, которые высоко консервативны по таксонов С момента своего открытия, Drosophila nompC участвует в mechanosensation (включая механическое раздражение кутикулы и обнаружение звука) и восприятие холода .
ГТО
| Семья | Подсемейство | Известные таксоны |
|---|---|---|
| ГТО | PKD1-подобный | Животные (кроме членистоногих) |
| PKD2-подобный | Животные | |
| Brividos | Насекомые |
TRPP , P от «полицистина», назван в честь поликистоза почек , связанного с этими каналами. Эти каналы также называют ионными каналами PKD (поликистическая болезнь киндей).
PKD2-подобные гены (примеры включают TRPP2 , TRPP3 и TRPP5 ) кодируют канонические каналы TRP. PKD1-подобные гены кодируют гораздо более крупные белки с 11 трансмембранными сегментами, которые не обладают всеми характеристиками других TRP-каналов. Однако 6 трансмебранных сегментов PKD1-подобных белков имеют существенную гомологию последовательностей с TRP-каналами, что указывает на то, что они могут просто сильно отличаться от других близкородственных белков.
У насекомых есть третье подсемейство TRPP, называемое brividos, которое участвует в зондировании холода.
TRPS
TRPS, S для Соромеластатина, был назван, поскольку он образует сестринскую группу по отношению к TRPM. TRPS широко присутствует у животных, но особенно отсутствует у позвоночных и насекомых (среди прочих). TRPS еще недостаточно хорошо описаны функционально, хотя известно, что TRPS C. elegans , известный как CED-11, представляет собой кальциевый канал, который участвует в апоптозе .
TRPV
| Семья | Подсемейство | Известные таксоны |
|---|---|---|
| TRPV | Наньчжун | Плакозои , книдарии, нематоды, кольчатые червецы, моллюски и членистоногие (возможно, за исключением паукообразных ) |
| Неактивный | ||
| TRPV1 | Специфично для позвоночных | |
| TRPV2 | ||
| TRPV3 | ||
| TRPV4 | ||
| TRPV5 | ||
| TRPV6 |
TRPV, V означает «ваниллоид», был первоначально обнаружен у Caenorhabditis elegans и назван в честь ваниллоидных химических веществ, которые активируют некоторые из этих каналов. Эти каналы известны своей ассоциацией с такими молекулами, как капсаицин (агонист TRPV1). Помимо 6 известных паралогов позвоночных, известны 2 основные клады за пределами детеростомов: nanchung и Iav. Механистические исследования этих последних клад были в основном ограничены Drosophila , но филогенетический анализ поместил в них ряд других генов от Placozoa, Annelida, Cnidaria, Mollusca и других членистоногих. Каналы TRPV также описаны у протистов.
TRPVL
Предполагается, что TRPVL является сестринской кладой TRPV и ограничивается книдариями Nematostella vectensis и Hydra magnipapillata , а также кольчатыми червями Capitella teleta . Об этих каналах мало что известно.
TRPY
TRPY, Y для «дрожжей», сильно локализован в дрожжевой вакуоли, которая является функциональным эквивалентом лизосомы в клетке млекопитающего, и действует как механосенсор для вакуумного осмотического давления. Методы фиксации пластыря и гиперосмотическая стимуляция показали, что TRPY играет роль во внутриклеточном высвобождении кальция. Филогенетический анализ показал, что TRPY1 не входит в состав др. TRP групп 1 и 2 многоклеточных, и предполагается, что он эволюционировал после дивергенции многоклеточных животных и грибов. Другие указали, что TRPY более тесно связаны с TRPP.
Состав
Каналы TRP состоят из 6 проникающих через мембрану спиралей (S1-S6) с внутриклеточными N- и C-концами . TRP-каналы млекопитающих активируются и регулируются широким спектром стимулов, включая многие посттранскрипционные механизмы, такие как фосфорилирование , связывание рецептора G-белка , лиганд-стробирование и убиквитинирование . Рецепторы обнаружены почти во всех типах клеток и в основном локализованы в мембранах клеток и органелл, модулируя проникновение ионов.
Большинство каналов TRP при полной функциональности образуют гомо- или гетеротетрамеры. Фильтр ионной селективности, поры, образован сложной комбинацией р-петель в тетрамерном белке, которые расположены во внеклеточном домене между трансмембранными сегментами S5 и S6. Как и большинство катионных каналов, TRP-каналы содержат отрицательно заряженные остатки внутри поры для притяжения положительно заряженных ионов.
Характеристики группы 1
Каждый канал в этой группе структурно уникален, что увеличивает разнообразие функций, которыми обладают каналы TRP, однако есть некоторые общие черты, которые отличают эту группу от других. Начиная с внутриклеточного N-конца, существуют анкрииновые повторы различной длины (кроме TRPM), которые способствуют закреплению мембраны и другим взаимодействиям с белками. Вскоре после S6 на C-конце находится высококонсервативный домен TRP (кроме TRPA), который участвует в модуляции стробирования и мультимеризации каналов. Другие С-концевые модификации, такие как домены альфа-киназы в TRPM7 и M8, также были замечены в этой группе.
Характеристики группы 2
Наиболее отличительный признак второй группы - это длинный внеклеточный промежуток между трансмембранными сегментами S1 и S2. У членов второй группы также отсутствуют анкрииновые повторы и TRP-домен. Однако было показано, что они имеют удерживающие последовательности эндоплазматического ретикулума (ER) ближе к C-концевому концу, что иллюстрирует возможные взаимодействия с ER.
Функция
Каналы TRP модулируют движущие силы входа ионов и механизмы транспорта Ca 2+ и Mg 2+ в плазматической мембране, где находится большинство из них. TRP имеют важные взаимодействия с другими белками и часто образуют сигнальные комплексы, точные пути которых неизвестны. Каналы TRP были первоначально обнаружены у мутантного штамма trp плодовой мушки Drosophila, который обнаруживал временное повышение потенциала в ответ на световые стимулы и были так названы временными каналами рецепторного потенциала . Каналы TRPML функционируют как каналы высвобождения внутриклеточного кальция и, таким образом, играют важную роль в регуляции органелл. Важно отметить, что многие из этих каналов опосредуют различные ощущения, такие как ощущение боли, температуры, различных вкусов, давления и зрения. Считается, что в организме некоторые каналы TRP ведут себя как микроскопические термометры и используются у животных для определения тепла или холода. TRP действуют как датчики осмотического давления , объема , растяжения и вибрации . Было замечено, что TRP играют сложные многомерные роли в передаче сенсорных сигналов. Многие TRP функционируют как каналы высвобождения внутриклеточного кальция.
Боль и температурное ощущение
Ионные каналы TRP преобразуют энергию в потенциалы действия в соматосенсорных ноцицепторах. Каналы Thermo-TRP имеют С-концевой домен, который отвечает за термочувствительность, и имеют специфическую взаимозаменяемую область, которая позволяет им воспринимать температурные стимулы, связанные с процессами регуляции лиганда. Хотя большинство каналов TRP модулируются изменениями температуры, некоторые из них играют решающую роль в температурных ощущениях. Существует как минимум 6 различных каналов Thermo-TRP, каждый из которых играет свою роль. Например, TRPM8 относится к механизмам восприятия холода, TRPV1 и TRPM3 способствуют возникновению ощущений тепла и воспаления, а TRPA1 облегчает многие сигнальные пути, такие как сенсорная трансдукция, ноцицепция , воспаление и окислительный стресс .
Вкус
TRPM5 участвует в вкусовой сигнализации сладкого , горького и юмами вкусов путем модуляции пути сигнала в тип II вкусовых рецепторов клеток. TRPM5 активируется сладкими гликозидами, содержащимися в стевии .
Несколько других каналов TRP играют важную роль в химиочувствительности через сенсорные нервные окончания во рту, которые не зависят от вкусовых рецепторов. TRPA1 реагирует на горчичное масло ( аллилизотиоцианат ), васаби и корицу, TRPA1 и TRPV1 реагирует на чеснок ( аллицин ), TRPV1 реагирует на перец чили ( капсаицин ), TRPM8 активируется ментолом , камфарой , мятой и охлаждающими агентами; TRPV2 активируется молекулами ( THC , CBD и CBN ), обнаруженными в марихуане.
TRP-подобные каналы в зрении насекомых

В ГТО -mutant плодовых мушек, которые испытывают недостаток в функциональную копию гену ГТО, характеризуется транзиторной реакция на свет, в отличии от мух дикого типа , которые демонстрируют устойчивую фоторецептор клетки активности в ответ на свет. Дистанционно родственная изоформа TRP-канала, TRP-подобный канал (TRPL), была позже идентифицирована в фоторецепторах Drosophila , где она экспрессируется примерно в 10-20 раз ниже, чем белок TRP. Впоследствии была выделена мутантная муха trpl . Помимо структурных различий, каналы TRP и TRPL различаются по катионной проницаемости и фармакологическим свойствам.
Каналы TRP / TRPL несут полную ответственность за деполяризацию плазматической мембраны фоторецепторов насекомых в ответ на свет. Когда эти каналы открываются, они позволяют натрию и кальцию проникать в клетку вниз по градиенту концентрации, что деполяризует мембрану. Вариации интенсивности света влияют на общее количество открытых TRP / TRPL каналов и, следовательно, на степень деполяризации мембраны. Эти градиентные реакции напряжения распространяются на синапсы фоторецепторов с нейронами сетчатки второго порядка и далее в мозг.
Важно отметить, что механизм фоторецепции насекомых кардинально отличается от такового у млекопитающих. Возбуждение родопсина в фоторецепторах млекопитающих приводит к гиперполяризации рецепторной мембраны, но не к деполяризации, как в глазу насекомых. У дрозофилы и, как предполагается, других насекомых, сигнальный каскад, опосредованный фосфолипазой C (PLC), связывает фотовозбуждение родопсина с открытием TRP / TRPL каналов. Хотя многочисленные активаторы этих каналов, такие как фосфатидилинозитол-4,5-бисфосфат (PIP 2 ) и полиненасыщенные жирные кислоты (ПНЖК), были известны в течение многих лет, ключевой фактор, опосредующий химическое соединение между PLC и каналами TRP / TRPL, оставался загадкой до недавнего времени. Было обнаружено, что распад липидного продукта каскада PLC, диацилглицерина (DAG), ферментом диацилглицерин липазой , генерирует PUFA, которые могут активировать каналы TRP, тем самым инициируя деполяризацию мембраны в ответ на свет. Этот механизм активации TRP-канала может хорошо сохраняться среди других типов ячеек, где эти каналы выполняют различные функции.
Клиническое значение
Мутации в TRP связаны с нейродегенеративными расстройствами, дисплазией скелета , заболеваниями почек и могут играть важную роль в развитии рака. TRP могут стать важными терапевтическими мишенями. Существует важное клиническое значение роли TRPV1, TRPV2, TRPV3 и TRPM8 как терморецепторов, а также роли TRPV4 и TRPA1 как механорецепторов; уменьшение хронической боли может быть возможным за счет воздействия на ионные каналы, участвующие в тепловых, химических и механических ощущениях, для снижения их чувствительности к стимулам. Например, использование агонистов TRPV1 потенциально может ингибировать ноцицепцию на TRPV1, особенно в ткани поджелудочной железы, где TRPV1 экспрессируется в высокой степени. Было показано, что агонист TRPV1 капсаицин, содержащийся в перце чили, облегчает нейропатическую боль. Агонисты TRPV1 подавляют ноцицепцию на TRPV1
Роль в раке
Измененная экспрессия белков TRP часто приводит к онкогенезу , как сообщается для TRPV1, TRPV6, TRPC1, TRPC6, TRPM4, TRPM5 и TRPM8. TRPV1 и TRPV2 вовлечены в рак груди. Экспрессия TRPV1 в агрегатах, обнаруженных в эндоплазматическом ретикулуме или аппарате Гольджи и / или окружающих эти структуры у пациентов с раком груди, снижает выживаемость. TRPV2 является потенциальным биомаркером и терапевтической мишенью при тройном отрицательном раке молочной железы. Семейство ионных каналов TRPM особенно связано с раком простаты, где TRPM2 (и его длинная некодирующая РНК TRPM2-AS ), TRPM4 и TRPM8 сверхэкспрессируются при раке простаты, что связано с более агрессивными исходами. Было показано, что TRPM3 способствует росту и аутофагии при светлоклеточной почечно-клеточной карциноме, TRPM4 сверхэкспрессируется в диффузной крупноклеточной B-клеточной лимфоме , что снижает выживаемость, тогда как TRPM5 обладает онкогенными свойствами при меланоме .
Роль в воспалительных реакциях
В дополнение к путям, опосредованным TLR4 , некоторые члены семейства транзиторных ионных каналов рецепторного потенциала распознают LPS . LPS-опосредованная активация TRPA1 была показана на мышах и мухах Drosophila melanogaster . При более высоких концентрациях LPS активирует также другие члены семейства сенсорных TRP-каналов, такие как TRPV1, TRPM3 и в некоторой степени TRPM8. LPS распознается TRPV4 на эпителиальных клетках. Активация TRPV4 LPS была необходима и достаточна для индукции продукции оксида азота с бактерицидным эффектом.
История TRP-каналов дрозофилы
Первоначальный TRP-мутант у дрозофилы был впервые описан Козенсом и Мэннингом в 1969 году как «мутантный штамм D. melanogaster, который, хотя и ведет себя позитивно в фототактическом отношении в Т-лабиринте при слабом окружающем освещении, у него нарушение зрения и он ведет себя как слепой». . Он также показал аномальный отклик фоторецепторов на свет на электроретинограмме, который был временным, а не устойчивым, как у «дикого типа». Впоследствии он был исследован Барухом Минке, пост-доктором в группе Уильяма Пака, и назван TRP в соответствии с его поведением в ERG. Идентичность мутированного белка была неизвестна до тех пор, пока он не был клонирован Крейгом Монтеллом, научным сотрудником исследовательской группы Джеральда Рубина, в 1989 году, который отметил его предполагаемую структурную связь с известными в то время каналами, а также Роджером Харди и Барухом Минке, которые предоставили данные 1992 г., свидетельствующие о том, что это ионный канал, который открывается в ответ на световую стимуляцию. Канал TRPL был клонирован и охарактеризован в 1992 году исследовательской группой Леонарда Келли.
использованная литература
дальнейшее чтение
внешние ссылки
- Transient + Receptor + Potential + каналы в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- «Переходные потенциальные каналы рецепторов» . База данных рецепторов и ионных каналов IUPHAR . Международный союз фундаментальной и клинической фармакологии.
- Clapham DE, DeCaen P, Carvacho I., Chaudhuri D, Doerner JF, Julius D, et al. «Переходные каналы рецепторного потенциала» . Руководство по фармакологии IUPHAR / BPS.
- «База данных TRIP» . вручную подобранная база данных белок-белковых взаимодействий для TRP-каналов млекопитающих .