Вычисление медицинских изображений - Medical image computing
Вычисление медицинских изображений (MIC) - это междисциплинарная область на стыке компьютерных наук , информационной инженерии , электротехники , физики , математики и медицины . В этой области разрабатываются вычислительные и математические методы для решения задач, относящихся к медицинским изображениям, и их использования для биомедицинских исследований и клинической помощи.
Основная цель MIC - извлечь клинически значимую информацию или знания из медицинских изображений. Будучи тесно связанным с областью медицинской визуализации , MIC фокусируется на вычислительном анализе изображений, а не на их получении. Эти методы могут быть сгруппированы в несколько основных категорий: сегментации изображений , регистрация изображения , изображения на основе физиологического моделирования и др.
Формы данных
Вычисление медицинских изображений обычно работает с однородно дискретизированными данными с регулярным пространственным интервалом xyz (изображения в 2D и объемы в 3D, обычно называемые изображениями). В каждой точке выборки данные обычно представлены в интегральной форме, такой как знаковые и беззнаковые короткие (16-разрядные), хотя формы от беззнаковых char (8-разрядных) до 32-разрядных чисел с плавающей запятой не редкость. Конкретное значение данных в точке выборки зависит от модальности: например, получение КТ собирает значения радиоплотности, в то время как получение МРТ может собирать изображения, взвешенные по T1 или T2 . Продольные, изменяющиеся во времени захваты могут получать или не получать изображения с регулярными временными шагами. Веерообразные изображения из-за таких модальностей, как ультразвук с изогнутой решеткой , также распространены и требуют различных репрезентативных и алгоритмических методов для обработки. Другие формы данных включают срезанные изображения из-за наклона гентри во время сбора данных; и неструктурированные сетки , такие как гексаэдрические и тетраэдрические формы, которые используются в продвинутом биомеханическом анализе (например, деформация тканей, перенос сосудов, костные имплантаты).
Сегментация
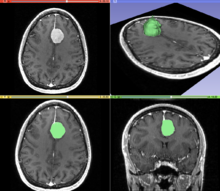
Сегментация - это процесс разделения изображения на разные значимые сегменты. В медицинской визуализации эти сегменты часто соответствуют различным классам тканей, органам , патологиям или другим биологически значимым структурам. Сегментация медицинских изображений затруднена из-за низкой контрастности, шума и других неоднозначностей изображения. Хотя существует множество методов компьютерного зрения для сегментации изображений , некоторые из них были адаптированы специально для обработки медицинских изображений. Ниже приведены примеры методов в этой области; реализация основана на опыте, который могут предоставить клиницисты.
- Сегментация на основе атласа : для многих приложений клинический эксперт может вручную пометить несколько изображений; сегментирование невидимых изображений - это вопрос экстраполяции этих вручную помеченных обучающих изображений. Методы этого стиля обычно называют методами сегментации на основе атласа. Методы параметрического атласа обычно объединяют эти обучающие изображения в одно изображение атласа, тогда как непараметрические методы атласа обычно используют все обучающие изображения по отдельности. Методы на основе атласа обычно требуют использования регистрации изображения , чтобы выровнять изображение или изображения атласа с новым, невидимым изображением.
- Сегментация на основе формы : многие методы параметризуют форму шаблона для данной структуры, часто полагаясь на контрольные точки вдоль границы. Затем вся форма деформируется, чтобы соответствовать новому изображению. Двумя наиболее распространенными методами на основе формы являются модели активной формы и модели активного внешнего вида. Эти методы оказали большое влияние и породили аналогичные модели.
- Сегментация на основе изображений : некоторые методы инициируют шаблон и уточняют его форму в соответствии с данными изображения, сводя к минимуму меры интегральной погрешности, такие как модель активного контура и ее вариации.
- Интерактивная сегментация : интерактивные методы полезны, когда врачи могут предоставить некоторую информацию, такую как область семян или приблизительный контур области для сегментации. Затем алгоритм может итеративно уточнять такую сегментацию под руководством врача или без него. Сегментация вручную с использованием таких инструментов, как кисть для явного определения класса ткани каждого пикселя, остается золотым стандартом для многих приложений обработки изображений. Недавно принципы теории управления с обратной связью были включены в сегментацию, что дает пользователю гораздо большую гибкость и позволяет автоматически исправлять ошибки.
- Субъективная поверхностная сегментация: этот метод основан на идее эволюции функции сегментации, которая регулируется моделью адвекции-диффузии. Чтобы сегментировать объект, требуется начальное значение сегментации (это начальная точка, которая определяет приблизительное положение объекта на изображении). Следовательно, строится начальная функция сегментации. Идея метода субъективной поверхности заключается в том, что положение семени является основным фактором, определяющим форму этой функции сегментации.
Однако существует и другая классификация методов сегментации изображений, аналогичная вышеперечисленным категориям. Более того, мы можем классифицировать другую группу как «Гибридную», основанную на комбинации методов.
Регистрация
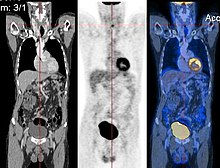
Регистрация изображений - это процесс поиска правильного совмещения изображений. В простейшем случае выравниваются два изображения. Обычно одно изображение обрабатывается как целевое изображение, а другое - как исходное; исходное изображение преобразуется, чтобы соответствовать целевому изображению. Процедура оптимизации обновляет преобразование исходного изображения на основе значения подобия, которое оценивает текущее качество совмещения. Эта итерационная процедура повторяется до тех пор, пока не будет найден (локальный) оптимум. Примером может служить регистрация изображений КТ и ПЭТ для объединения структурной и метаболической информации (см. Рисунок).
Регистрация изображений используется в различных медицинских приложениях:
- Изучение временных изменений. Продольные исследования получают изображения в течение нескольких месяцев или лет для изучения долгосрочных процессов, таких как прогрессирование заболевания. Временные ряды соответствуют изображениям, полученным в течение одного сеанса (секунды или минуты). Их можно использовать для изучения когнитивных процессов, деформаций сердца и дыхания.
- Объединение дополнительной информации из различных методов визуализации . Примером может служить сочетание анатомической и функциональной информации. Поскольку размер и форма структур различаются в зависимости от модальности, оценить качество выравнивания сложнее. Это привело к использованию таких показателей сходства , как взаимная информация .
- Характеристика совокупности субъектов. В отличие от внутрипредметной регистрации, взаимно однозначное сопоставление между субъектами может не существовать, в зависимости от структурной изменчивости интересующего органа. Для построения атласа по вычислительной анатомии требуется межпредметная регистрация . Здесь цель состоит в том, чтобы статистически смоделировать анатомию органов у разных испытуемых.
- Компьютерная хирургия . В компьютерной хирургии предоперационные изображения, такие как КТ или МРТ, регистрируются в интраоперационных изображениях или системах слежения, чтобы облегчить управление изображением или навигацию.
При регистрации изображения следует учитывать несколько важных моментов:
- Модель трансформации . Обычно выбираются жесткие , аффинные и деформируемые модели трансформации. B-сплайн и модели тонких пластин обычно используются для параметризованных полей преобразования. Непараметрические или плотные поля деформации несут вектор смещения в каждом месте сетки; это требует дополнительных ограничений регуляризации . Особым классом полей деформаций являются диффеоморфизмы , которые представляют собой обратимые преобразования с гладким обратным.
- Метрика подобия. Функция расстояния или сходства используется для количественной оценки качества регистрации. Это сходство может быть рассчитано либо на исходных изображениях, либо на элементах, извлеченных из изображений. Общие меры сходства - это сумма квадратов расстояний (SSD), коэффициент корреляции и взаимная информация . Выбор меры сходства зависит от того, принадлежат ли изображения к одной и той же модальности; шум захвата также может сыграть роль в этом решении. Например, SSD - это оптимальная мера сходства для изображений одной модальности с гауссовым шумом . Однако статистика изображения в ультразвуке значительно отличается от гауссовского шума, что приводит к введению специфических для ультразвука критериев сходства. Мультимодальная регистрация требует более сложной меры сходства; в качестве альтернативы может использоваться другое представление изображения, такое как структурные представления или регистрация смежной анатомии.
- Процедура оптимизации . Выполняется либо непрерывная, либо дискретная оптимизация . Для непрерывной оптимизации применяются методы оптимизации на основе градиента для повышения скорости сходимости.
Визуализация
Визуализация играет несколько ключевых ролей в вычислении медицинских изображений. Методы научной визуализации используются для понимания и передачи медицинских изображений, которые по своей сути пространственно-временны. Визуализация и анализ данных используются в формах неструктурированных данных , например, при оценке статистических показателей, полученных во время алгоритмической обработки. Прямое взаимодействие с данными, ключевая особенность процесса визуализации, используется для выполнения визуальных запросов к данным, аннотирования изображений, управления процессами сегментации и регистрации и управления визуальным представлением данных (путем управления свойствами визуализации освещения и параметрами просмотра). Визуализация используется как для первоначального исследования, так и для передачи промежуточных и окончательных результатов анализа.
Рисунок «Визуализация медицинской визуализации» иллюстрирует несколько типов визуализации: 1. отображение поперечных сечений в виде изображений в градациях серого; 2. переформатированные виды изображений в градациях серого (сагиттальный вид в этом примере имеет другую ориентацию, чем исходное направление получения изображения; и 3. трехмерная объемная визуализация тех же данных. Узловое поражение четко видно на разных презентациях. и отмечен белой линией.
Атласы
Медицинские изображения могут значительно различаться у разных людей из-за того, что у людей есть органы разных форм и размеров. Поэтому представление медицинских изображений для учета этой изменчивости имеет решающее значение. Популярным подходом к представлению медицинских изображений является использование одного или нескольких атласов. Здесь атлас относится к конкретной модели для совокупности изображений с параметрами, которые получены из набора обучающих данных.
Простейшим примером атласа является изображение средней яркости, обычно называемое шаблоном. Однако атлас может также включать более обширную информацию, такую как статистика локальных изображений и вероятность того, что конкретное пространственное местоположение имеет определенную метку. Новые медицинские изображения, которые не используются во время обучения, можно сопоставить с атласом, который был адаптирован для конкретного приложения, такого как сегментация и групповой анализ . Сопоставление изображения с атласом обычно включает регистрацию изображения и атласа. Эту деформацию можно использовать для устранения вариабельности медицинских изображений.
Единый шаблон
Самый простой подход - смоделировать медицинские изображения как деформированные версии одного шаблона изображения. Например, анатомические МРТ-сканирование головного мозга часто сопоставляются с шаблоном MNI для представления всех сканированных изображений головного мозга в общих координатах. Главный недостаток подхода с одним шаблоном заключается в том, что при наличии значительных различий между шаблоном и данным тестовым изображением может не быть хорошего способа сопоставить одно изображение с другим. Например, анатомическое МРТ-сканирование мозга пациента с серьезными аномалиями головного мозга (например, опухоль или хирургическая процедура) не может легко сопоставить с шаблоном MNI.
Несколько шаблонов
Вместо того, чтобы полагаться на один шаблон, можно использовать несколько шаблонов. Идея состоит в том, чтобы представить изображение как деформированную версию одного из шаблонов. Например, может быть один шаблон для здорового населения и один шаблон для больного населения. Однако во многих приложениях неясно, сколько шаблонов необходимо. Простой, хотя и дорогостоящий в вычислительном отношении способ справиться с этим - сделать так, чтобы каждое изображение в наборе обучающих данных было шаблоном, и, таким образом, каждое новое обнаруженное изображение сравнивается с каждым изображением в наборе обучающих данных. Более новый подход автоматически определяет количество необходимых шаблонов.
статистический анализ
Статистические методы объединяют область медицинской визуализации с современным компьютерным зрением , машинным обучением и распознаванием образов . За последнее десятилетие несколько больших наборов данных стали общедоступными (см., Например, ADNI, Проект 1000 функциональных коннектомов), отчасти благодаря сотрудничеству между различными институтами и исследовательскими центрами. Это увеличение объема данных требует новых алгоритмов, которые могут анализировать и обнаруживать малозаметные изменения в изображениях для решения клинических вопросов. Такие клинические вопросы очень разнообразны и включают групповой анализ, визуализацию биомаркеров, фенотипирование заболевания и продольные исследования.
Групповой анализ
В групповом анализе цель состоит в том, чтобы обнаружить и количественно оценить отклонения, вызванные заболеванием, путем сравнения изображений двух или более когорт. Обычно одна из этих когорт состоит из нормальных (контрольных) субъектов, а другая - из пациентов с отклонениями от нормы. Вариация, вызванная заболеванием, может проявляться как аномальная деформация анатомии (см. Морфометрия на основе вокселей ). Например, сокращение подкорковых тканей, таких как гиппокамп в головном мозге, может быть связано с болезнью Альцгеймера . Кроме того, изменения биохимической (функциональной) активности можно наблюдать с помощью методов визуализации, таких как позитронно-эмиссионная томография .
Сравнение между группами обычно проводится на уровне вокселей . Следовательно, самый популярный конвейер предварительной обработки, особенно в нейровизуализации , преобразует все изображения в наборе данных в общую систему координат с помощью ( регистрации медицинских изображений ), чтобы поддерживать соответствие между вокселями. Учитывая это соответствие вокселов, наиболее распространенным методом Frequentist является извлечение статистики для каждого воксела (например, средняя интенсивность вокселов для каждой группы) и выполнение статистической проверки гипотез, чтобы оценить, поддерживается или не поддерживается нулевая гипотеза. Нулевая гипотеза обычно предполагает, что две когорты взяты из одного и того же распределения и, следовательно, должны иметь одинаковые статистические свойства (например, средние значения двух групп равны для определенного вокселя). Поскольку медицинские изображения содержат большое количество вокселей, необходимо решить проблему множественного сравнения . Существуют также байесовские подходы к решению проблемы группового анализа.
Классификация
Хотя групповой анализ может количественно оценить общие эффекты патологии на анатомию и функцию, он не обеспечивает измерения уровня субъекта и, следовательно, не может использоваться в качестве биомаркеров для диагностики (см. Биомаркеры визуализации). С другой стороны, клиницисты часто заинтересованы в ранней диагностике патологии (т. Е. Классификации) и изучении прогрессирования заболевания (т. Е. Регрессии). С методологической точки зрения текущие методы варьируются от применения стандартных алгоритмов машинного обучения к наборам данных медицинской визуализации (например, машины опорных векторов ) до разработки новых подходов, адаптированных для нужд данной области. Основные трудности заключаются в следующем:
- Малый размер выборки ( проклятие размерности ): большой набор данных медицинской визуализации содержит от сотен до тысяч изображений, тогда как количество вокселей в типичном объемном изображении может легко превысить миллионы. Решением этой проблемы является уменьшение количества функций в информативном смысле (см. Уменьшение размерности ). Для решения этой проблемы было предложено несколько неконтролируемых и полу- / контролируемых подходов.
- Интерпретируемость: хорошая точность обобщения не всегда является основной целью, поскольку врачи хотели бы понять, какие части анатомии затронуты заболеванием. Поэтому интерпретируемость результатов очень важна; методы, игнорирующие структуру изображения, не приветствуются. Были предложены альтернативные методы, основанные на выборе признаков .
Кластеризация
Методы классификации паттернов на основе изображений обычно предполагают, что неврологические эффекты заболевания отчетливы и четко определены. Так бывает не всегда. По ряду медицинских состояний популяции пациентов весьма неоднородны, и дальнейшая категоризация по подусловиям не проводилась. Кроме того, некоторые заболевания (например, расстройство аутистического спектра (РАС), шизофрения , легкие когнитивные нарушения (MCI)) могут характеризоваться непрерывным или почти непрерывным спектром от легкого когнитивного нарушения до очень выраженных патологических изменений. Чтобы облегчить анализ гетерогенных расстройств на основе изображений, были разработаны методологические альтернативы классификации паттернов. Эти методы заимствуют идеи из многомерной кластеризации и многомерной регрессии паттернов для кластеризации данной популяции в однородные подгруппы. Цель состоит в том, чтобы обеспечить лучшее количественное понимание болезни в каждой подгруппе населения.
Анализ формы
Анализ формы - это область обработки медицинских изображений, которая изучает геометрические свойства структур, полученных с помощью различных методов визуализации . В последнее время анализ формы становится все более интересным для медицинского сообщества из-за его способности точно определять морфологические изменения между различными популяциями структур, то есть здоровыми и патологическими, женщинами и мужчинами, молодыми и пожилыми. Анализ формы включает два основных этапа: соответствие форм и статистический анализ.
- Соответствие форм - это методология вычисления соответствующих местоположений между геометрическими фигурами, представленными сетками треугольников, контурами, наборами точек или объемными изображениями. Очевидно, что определение соответствия напрямую повлияет на анализ. Среди различных вариантов структур соответствия мы можем найти: анатомическое соответствие, ручные ориентиры, функциональное соответствие (то есть в локусе морфометрии мозга, отвечающем за одну и ту же нейронную функциональность), геометрическое соответствие, (для объемов изображений) сходство интенсивности и т. Д. Некоторые подходы, например спектральные анализа формы, не требуют соответствия, а сравнивают дескрипторы формы напрямую.
- Статистический анализ позволит измерить структурные изменения в соответствующих местах.
Продольные исследования
В лонгитюдных исследованиях один и тот же человек отображается повторно. Эта информация может быть включена как в анализ изображений , так и в статистическое моделирование.
- При продольной обработке изображений методы сегментации и анализа отдельных моментов времени информируются и упорядочиваются с помощью общей информации, обычно из внутриобъектного шаблона. Эта регуляризация предназначена для уменьшения шума измерения и, таким образом, помогает повысить чувствительность и статистическую мощность. В то же время необходимо избегать чрезмерной регуляризации, чтобы размеры эффекта оставались стабильными. Например, интенсивная регуляризация может привести к превосходной надежности повторного тестирования, но ограничивает возможность обнаружения любых истинных изменений и различий между группами. Часто необходимо найти компромисс, который оптимизирует снижение шума за счет ограниченной потери размера эффекта. Другой распространенной проблемой при продольной обработке изображений является, часто непреднамеренное, смещение обработки. Когда, например, последующие изображения регистрируются и передискретизируются в базовое изображение, артефакты интерполяции появляются только в последующих изображениях, но не в базовом. Эти артефакты могут вызывать ложные эффекты (обычно склонность к переоценке продольных изменений и, таким образом, к недооценке требуемого размера выборки). Поэтому важно, чтобы все точки обрабатывались точно так же, чтобы избежать ошибок обработки.
- Постобработка и статистический анализ продольных данных обычно требует специальных статистических инструментов, таких как дисперсионный анализ с повторными измерениями или более мощные линейные модели со смешанными эффектами. Кроме того, полезно учитывать пространственное распределение сигнала. Например, измерения толщины кортикального слоя покажут корреляцию внутри субъекта во времени, а также в пределах области на корковой поверхности - факт, который можно использовать для увеличения статистической мощности. Кроме того, анализ времени до события (он же выживаемость) часто используется для анализа продольных данных и определения значимых предикторов.
Физиологическое моделирование на основе изображений
Традиционно обработка медицинских изображений направлена на количественную оценку и объединение структурной или функциональной информации, доступной в момент и время получения изображения. В этом отношении его можно рассматривать как количественное определение основных анатомических, физических или физиологических процессов. Однако в последние несколько лет растет интерес к прогнозной оценке заболевания или курса терапии. Таким образом, моделирование на основе изображений, будь то биомеханическое или физиологическое моделирование, может расширить возможности вычисления изображений с описательной до прогнозной.
Согласно плану исследований STEP, Virtual Physiological Human (VPH) представляет собой методологическую и технологическую основу, которая после создания позволит исследовать человеческое тело как единую сложную систему. Основываясь на концепции VPH, Международный союз физиологических наук (IUPS) более десяти лет спонсирует проект IUPS Physiome Project . Это всемирное общественное достояние, цель которого - предоставить вычислительную основу для понимания физиологии человека. Он направлен на разработку интегративных моделей на всех уровнях биологической организации, от генов до целых организмов через генные регуляторные сети, белковые пути, интегративные функции клеток и взаимосвязи между структурой и функцией тканей и всего органа. Такой подход направлен на преобразование современной практики в медицине и лежит в основе новой эры компьютерной медицины.
В этом контексте медицинская визуализация и обработка изображений играют все более важную роль, поскольку они предоставляют системы и методы для визуализации, количественной оценки и объединения как структурной, так и функциональной информации о человеке in vivo. Эти две обширные области исследований включают преобразование общих вычислительных моделей для представления конкретных предметов, тем самым открывая путь для персонализированных вычислительных моделей. Индивидуализация общих вычислительных моделей посредством построения изображений может быть реализована в трех дополнительных направлениях:
- определение предметной вычислительной области (анатомии) и связанных субдоменов (типов тканей);
- определение граничных и начальных условий из (динамического и / или функционального) изображения; а также
- характеристика структурных и функциональных свойств тканей.
Кроме того, визуализация также играет ключевую роль в оценке и валидации таких моделей как на людях, так и на животных моделях, а также в переводе моделей в клинические условия как для диагностических, так и для терапевтических целей. В этом конкретном контексте молекулярная, биологическая и доклиническая визуализация предоставляют дополнительные данные и понимание базовой структуры и функции в молекулах, клетках, тканях и моделях животных, которые могут быть перенесены в физиологию человека, где это необходимо.
Применение моделей VPH / Physiome на основе изображений в базовой и клинической областях обширно. Вообще говоря, они обещают стать новыми виртуальными методами визуализации . Фактически, больше, часто ненаблюдаемые, параметры будут отображены in silico на основе интеграции наблюдаемых, но иногда разреженных и противоречивых мультимодальных изображений и физиологических измерений. Вычислительные модели служат для интерпретации измерений в соответствии с основными биофизическими, биохимическими или биологическими законами исследуемых физиологических или патофизиологических процессов. В конечном итоге такие исследовательские инструменты и системы помогут нам понять процессы болезни, естественную историю развития болезни и влияние фармакологических и / или интервенционных терапевтических процедур на течение болезни.
Взаимодействие между визуализацией и моделированием выходит за рамки интерпретации измерений в соответствии с физиологией. Моделирование на основе изображений, ориентированных на конкретного пациента, в сочетании с моделями медицинских устройств и фармакологической терапии открывает путь к прогнозирующей визуализации, с помощью которой можно понять, спланировать и оптимизировать такие вмешательства in silico .
Математические методы в медицинской визуализации
Ряд сложных математических методов вошел в медицинскую визуализацию и уже реализован в различных пакетах программного обеспечения. К ним относятся подходы, основанные на уравнениях в частных производных (PDE) и потоках, управляемых кривизной, для улучшения, сегментации и регистрации. Поскольку они используют PDE, методы можно распараллелить и реализовать на GPGPU. Некоторые из этих методов были основаны на идеях оптимального управления . Соответственно, совсем недавно идеи из контроля недавно стали использоваться в интерактивных методах, особенно в сегментации. Кроме того, из - за шума , а также необходимость статистических методов оценки для более динамически изменяющихся изображений, то фильтр Калмана и фильтр частиц вошли в употребление. Обзор этих методов с обширным списком ссылок можно найти в.
Вычисления, зависящие от модальности
Некоторые методы визуализации предоставляют очень специализированную информацию. Полученные изображения нельзя рассматривать как обычные скалярные изображения, и они дают начало новым подобластям обработки медицинских изображений. Примеры включают диффузионную МРТ , функциональную МРТ и другие.
Диффузионная МРТ
Диффузионная МРТ - это метод структурной магнитно-резонансной томографии, который позволяет измерять процесс диффузии молекул. Диффузия измеряется приложением градиентного импульса к магнитному полю в определенном направлении. В типичном сборе данных набор равномерно распределенных направлений градиента используется для создания набора взвешенных по диффузии объемов. Кроме того, невзвешенный объем получается в том же магнитном поле без применения градиентного импульса. Поскольку каждое получение связано с несколькими объемами, диффузионная МРТ создала ряд уникальных проблем в области обработки медицинских изображений.
В медицине диффузионная МРТ преследует две основные вычислительные цели :
- Оценка местных свойств ткани, таких как коэффициент диффузии;
- Оценка локальных направлений и глобальных путей распространения.
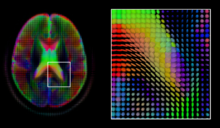
Тензора диффузии , 3 × 3 симметрична положительно определенная матрица , предлагает простое решение для обеих этих целей. Он пропорционален ковариационной матрице нормально распределенного профиля локальной диффузии, и, таким образом, доминирующий собственный вектор этой матрицы является главным направлением локальной диффузии. Благодаря простоте этой модели, оценка максимального правдоподобия тензора диффузии может быть найдена простым решением системы линейных уравнений в каждом месте независимо. Однако, поскольку предполагается, что объем содержит смежные тканевые волокна, может быть предпочтительнее оценить объем тензоров диффузии в целом, наложив условия регулярности на лежащее в основе поле тензоров. Из тензора диффузии могут быть извлечены скалярные значения, такие как фракционная анизотропия , средняя, осевая и радиальная диффузионные свойства , которые косвенно измеряют свойства ткани, такие как дисмиелинизация аксональных волокон или наличие отека. Стандартные методы вычисления скалярных изображений, такие как регистрация и сегментация, могут применяться непосредственно к объемам таких скалярных значений. Однако, чтобы полностью использовать информацию в тензоре диффузии, эти методы были адаптированы для учета тензорных объемов при выполнении регистрации и сегментации.
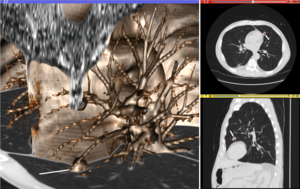
Учитывая главное направление распространения в каждом месте объема, можно оценить глобальные пути распространения с помощью процесса, известного как трактография . Однако из-за относительно низкого разрешения диффузной МРТ многие из этих путей могут пересекаться, целоваться или развеиваться в одном месте. В этой ситуации единственное главное направление тензора диффузии не является подходящей моделью для локального распределения диффузии. Наиболее распространенное решение этой проблемы - оценка нескольких направлений локальной диффузии с использованием более сложных моделей. К ним относятся смеси тензоров диффузии, визуализации Q-шара, визуализации спектра диффузии и функций распределения ориентации волокон, которые обычно требуют сбора данных HARDI с большим количеством направлений градиента. Как и в случае с тензором диффузии, объемы, оцениваемые с помощью этих сложных моделей, требуют специальной обработки при применении методов вычисления изображений, таких как регистрация и сегментация.
Функциональная МРТ
Функциональная магнитно-резонансная томография (фМРТ) - это метод медицинской визуализации, который косвенно измеряет нервную активность, наблюдая за местной гемодинамикой или сигналом, зависимым от уровня кислорода в крови (жирный шрифт). Данные фМРТ предлагают ряд инсайтов, и их можно условно разделить на две категории:
- ФМРТ, относящаяся к задаче , приобретается, когда субъект выполняет последовательность временных экспериментальных условий. В экспериментах с блочным дизайном условия присутствуют в течение коротких периодов времени (например, 10 секунд) и чередуются с периодами отдыха. Эксперименты, связанные с событиями, основываются на случайной последовательности стимулов и используют одну временную точку для обозначения каждого условия. Стандартный подход к анализу фМРТ, относящегося к задаче, - это общая линейная модель (GLM).
- ФМРТ в состоянии покоя проводится без каких-либо экспериментальных задач. Обычно целью является изучение внутренней сетевой структуры мозга. Наблюдения, сделанные во время отдыха, также были связаны с конкретными когнитивными процессами, такими как кодирование или отражение. Большинство исследований фМРТ в состоянии покоя сосредоточено на низкочастотных колебаниях сигнала фМРТ (LF-BOLD). Семенные открытия включают в себя сеть по умолчанию , комплексную корковую парцелляцию и привязку характеристик сети к поведенческим параметрам.
Существует богатый набор методологий, используемых для анализа данных функциональной нейровизуализации, и часто нет единого мнения относительно наилучшего метода. Вместо этого исследователи подходят к каждой проблеме независимо и выбирают подходящую модель / алгоритм. В этом контексте существует относительно активный обмен между сообществами нейробиологии , вычислительной биологии , статистики и машинного обучения . Известные подходы включают:
- Массивные одномерные подходы, которые исследуют отдельные вокселы в данных изображения на предмет их взаимосвязи с условиями эксперимента. Первичный подход - это общая линейная модель (GLM).
- Подходы на основе многовариантных и классификаторов , часто называемые многовоксельным анализом паттернов или многовариантным анализом паттернов, исследуют данные на предмет глобальных и потенциально распределенных реакций на экспериментальные условия. Ранние подходы использовали вспомогательные векторные машины (SVM) для изучения реакции на зрительные стимулы. Недавно были изучены альтернативные алгоритмы распознавания образов, такие как контраст Джини на основе случайного леса или разреженная регрессия и изучение словаря.
- Функциональный анализ связности изучает внутреннюю сетевую структуру мозга, включая взаимодействия между регионами. Большинство таких исследований сосредоточено на данных о состоянии покоя, чтобы проанализировать мозг или найти корреляты с поведенческими показателями. Данные по конкретным задачам можно использовать для изучения причинно-следственных связей между областями мозга (например, динамическое картирование причинно-следственных связей (DCM)).
При работе с большими когортами субъектов решающее значение имеет нормализация (регистрация) отдельных субъектов в общей системе отсчета. Существует множество работ и инструментов для выполнения нормализации на основе анатомии ( FSL , FreeSurfer , SPM ). Согласование с учетом пространственной изменчивости по предметам - более новое направление работы. Примерами являются выравнивание коры на основе корреляции сигналов фМРТ, выравнивание на основе глобальной функциональной структуры связности как в данных о задачах, так и в данных состояния покоя, а также выравнивание на основе профилей активации конкретных стимулов отдельных вокселей.
Программное обеспечение
Программное обеспечение для обработки медицинских изображений представляет собой сложную комбинацию систем, обеспечивающих ввод-вывод, визуализацию и взаимодействие, пользовательский интерфейс, управление данными и вычисления. Обычно системные архитектуры имеют многоуровневую структуру для обслуживания разработчиков алгоритмов, разработчиков приложений и пользователей. Нижние уровни часто представляют собой библиотеки и / или наборы инструментов, которые обеспечивают базовые вычислительные возможности; в то время как верхние слои представляют собой специализированные приложения, предназначенные для решения конкретных медицинских проблем, заболеваний или систем организма.
Дополнительные замечания
Вычисление медицинских изображений также связано с областью компьютерного зрения . Международное сообщество MICCAI представляет область и организует ежегодные конференции и связанные с ними семинары. Материалы конференции публикуются Springer в серии Lecture Notes in Computer Science. В 2000 г. Н. Аяче и Дж. Дункан проанализировали состояние отрасли.
Смотрите также
использованная литература
Журналы по медицинской обработке изображений
- Анализ медицинских изображений (MedIA) ; также официальный журнал Общества MICCAI , которое организует Ежегодную конференцию MICCAI - ведущую конференцию по медицинским вычислениям изображений.
- IEEE Transactions по медицинской визуализации (IEEE TMI)
- Медицинская физика
- Журнал цифровой обработки изображений (JDI) ; официальный журнал Общества информатики изображений
- Компьютеризированная медицинская визуализация и графика
- Журнал компьютерной радиологии и хирургии
- BMC Medical Imaging
Кроме того, следующие журналы время от времени публикуют статьи, описывающие методы и конкретные клинические применения вычислений медицинских изображений или обработки медицинских изображений с учетом конкретных модальностей.