Зажим патч - Patch clamp

Метод патч-зажима - это лабораторный метод в электрофизиологии, используемый для изучения ионных токов в отдельных изолированных живых клетках , срезах тканей или участках клеточной мембраны. Этот метод особенно полезен при исследовании возбудимых клеток, таких как нейроны , кардиомиоциты , мышечные волокна и бета-клетки поджелудочной железы , а также может быть применен для исследования бактериальных ионных каналов в специально подготовленных гигантских сферопластах .
Зажим патча может быть выполнен с использованием метода фиксации напряжения . В этом случае напряжение на клеточной мембране контролируется экспериментатором, и результирующие токи регистрируются. В качестве альтернативы можно использовать токовые клещи . В этом случае ток, проходящий через мембрану, контролируется экспериментатором, и результирующие изменения напряжения регистрируются, как правило, в форме потенциалов действия .
Эрвин Неер и Берт Сакманн разработали патч-зажим в конце 1970-х - начале 1980-х годов. Это открытие позволило впервые регистрировать токи молекул одиночных ионных каналов, что улучшило понимание участия каналов в фундаментальных клеточных процессах, таких как потенциалы действия и нервная активность. За эту работу Неер и Сакманн получили Нобелевскую премию по физиологии и медицине в 1991 году.
Базовая техника
Настраивать
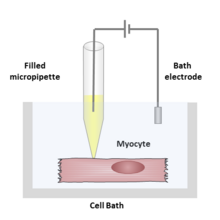
Во время записи с зажимом патч-зажим полая стеклянная трубка, известная как микропипетка или патч-пипетка, заполненная раствором электролита, и записывающий электрод, подключенный к усилителю, контактируют с мембраной изолированной ячейки . Другой электрод помещают в ванну, окружающую клетку или ткань, в качестве заземляющего электрода сравнения. Между регистрирующим электродом и электродом сравнения может быть сформирована электрическая цепь, а между ними - интересующая ячейка.
Раствор, заполняющий патч-пипетку, может соответствовать ионному составу раствора ванны, как в случае регистрации прикрепленных клеток, или соответствовать цитоплазме при регистрации целых клеток. Раствор в растворе для ванны может соответствовать физиологическому внеклеточному раствору, цитоплазме или быть полностью нефизиологическим, в зависимости от проводимого эксперимента. Исследователь также может изменить содержание раствора для ванны (или, реже, раствора для пипетки), добавляя ионы или лекарства для изучения ионных каналов в различных условиях.
В зависимости от того, что исследователь пытается измерить, диаметр используемого наконечника пипетки может варьироваться, но обычно он находится в диапазоне микрометров . Этот небольшой размер используется для ограждения участка поверхности клеточной мембраны или «участка», который часто содержит только одну или несколько молекул ионных каналов. Этот тип электрода отличается от «острого микроэлектрода», используемого для прокалывания клеток при традиционных внутриклеточных записях , тем, что он запечатан на поверхности клеточной мембраны, а не вставлен через нее.
В некоторых экспериментах, кончик микропипетки нагревает в microforge для получения гладкой поверхности , что способствует формированию высокого сопротивления уплотнения с клеточной мембраной. Чтобы получить это уплотнение с высоким сопротивлением, микропипетка прижимается к клеточной мембране и применяется отсасывание. Часть клеточной мембраны всасывается в пипетку, создавая омега- образную область мембраны, которая, если она сформирована должным образом, создает сопротивление в диапазоне 10–100 гигаомов , называемое «гигаомным уплотнением» или «гигаомным уплотнением». Высокое сопротивление этого уплотнения позволяет с помощью электроники изолировать токи, измеряемые через участок мембраны, с небольшим конкурирующим шумом , а также обеспечивает некоторую механическую стабильность записи.
Запись
Многие усилители с коммутационным зажимом не используют схему фиксации напряжения , а представляют собой дифференциальные усилители, которые используют электрод ванны для установки нулевого уровня тока (заземления). Это позволяет исследователю поддерживать постоянное напряжение, наблюдая за изменениями тока . Чтобы сделать эти записи, патч-пипетка сравнивается с заземляющим электродом. Затем в систему подается ток для поддержания постоянного заданного напряжения. Ток, необходимый для ограничения напряжения, противоположен по знаку и равен по величине току через мембрану.
В качестве альтернативы, ячейка может быть ограничена по току в режиме всей ячейки, поддерживая постоянный ток, наблюдая за изменениями напряжения на мембране .
Вариации
В зависимости от того, что исследователь хочет изучить, могут применяться несколько вариаций базовой техники. Методы «наизнанку-наружу» и «наружу-наружу» называются методами «вырезанного пятна», потому что пластырь вырезается (удаляется) из основной части клетки. Прикрепленные клетки и оба метода иссеченного пластыря используются для изучения поведения отдельных ионных каналов в секции мембраны, прикрепленной к электроду.
Пластырь целой ячейки и перфорированный пластырь позволяют исследователю изучать электрическое поведение всей ячейки вместо одиночных токов канала. Пластырь для всей клетки, который обеспечивает электрический доступ с низким сопротивлением внутрь клетки, в настоящее время в значительной степени заменил методы записи с использованием микроэлектродов с высоким сопротивлением для регистрации токов через всю клеточную мембрану.
Пластырь, прикрепленный к клетке
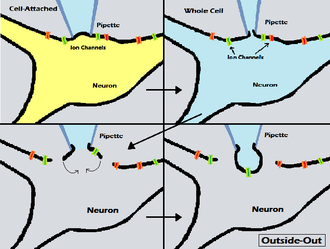
Для этого метода пипетка запаяна на клеточной мембране, чтобы получить гигазаль (уплотнение с электрическим сопротивлением порядка гигаома), при этом гарантируя, что клеточная мембрана остается неповрежденной. Это позволяет регистрировать токи через один или несколько ионных каналов, содержащихся в участке мембраны, захваченном пипеткой. Прикрепляясь только к внешней части клеточной мембраны, структура клетки практически не нарушается. Кроме того, если не нарушать внутреннюю часть клетки, любые внутриклеточные механизмы, обычно влияющие на канал, по-прежнему смогут функционировать так, как они будут физиологически. Используя этот метод, также относительно легко получить правильную конфигурацию, и после ее получения она довольно стабильна.
Для лиганд-управляемых ионных каналов или каналов, которые модулируются метаботропными рецепторами , исследуемый нейротрансмиттер или лекарственное средство обычно включается в раствор для пипетки, где он может взаимодействовать с тем, что раньше было внешней поверхностью мембраны. Результирующая активность канала может быть связана с используемым лекарственным средством, хотя обычно невозможно затем изменить концентрацию лекарственного средства внутри пипетки. Таким образом, методика ограничена одной точкой кривой доза-ответ на пластырь. Следовательно, доза-ответ достигается с использованием нескольких ячеек и пластырей. Однако потенциал-зависимые ионные каналы могут быть зажаты последовательно при разных мембранных потенциалах в одном участке. Это приводит к активации канала как функции напряжения, и полная кривая ВАХ (вольт-амперная характеристика) может быть построена только за один участок. Другой потенциальный недостаток этого метода заключается в том, что, поскольку внутриклеточные пути клетки не нарушены, они также не могут быть напрямую изменены.
Патч наизнанку
В методе «наизнанку-наружу» пластырь мембраны прикрепляется к пипетке для пластыря, отделяется от остальной части клетки, и цитозольная поверхность мембраны подвергается воздействию внешней среды или ванны. Одним из преимуществ этого метода является то, что экспериментатор имеет доступ к внутриклеточной поверхности мембраны через ванну и может изменять химический состав того, чему подвергается внутренняя поверхность мембраны. Это полезно, когда экспериментатор желает манипулировать окружающей средой на внутриклеточной поверхности одиночных ионных каналов. Например, каналы, которые активируются внутриклеточными лигандами, затем могут быть изучены с помощью диапазона концентраций лигандов.
Для достижения конфигурации «наизнанку-наружу» пипетка прикрепляется к клеточной мембране, как в режиме прикрепления к клетке, образуя гигазу, а затем втягивается, чтобы оторвать участок мембраны от остальной части клетки. Удаление мембранного пластыря часто сначала приводит к образованию мембранного пузырька на кончике пипетки, потому что концы мембранного пластыря быстро сливаются вместе после иссечения. Затем необходимо вскрыть внешнюю поверхность пузырька, чтобы перейти в режим «наизнанку»; это может быть сделано путем кратковременного проведения мембраны через границу раздела раствор / воздух в ванне, воздействия раствора с низким содержанием Ca 2+ или кратковременного контакта с каплей парафина или куском отвержденного силиконового полимера.
Запись целых клеток или пластыря целиком
Запись целых клеток включает в себя регистрацию токов по нескольким каналам одновременно в большой области клеточной мембраны. Электрод остается на ячейке, как и в записях, прикрепленных к ячейке, но применяется большее всасывание, чтобы разорвать мембранный пластырь, тем самым обеспечивая доступ изнутри пипетки во внутриклеточное пространство ячейки. Это дает возможность применять и изучать, как лечение (например, лекарства) может влиять на клетки в режиме реального времени. После того, как пипетка прикреплена к клеточной мембране, есть два метода сломать пластырь. Первый - усилить всасывание. Количество и продолжительность этого всасывания зависит от типа ячейки и размера пипетки. Другой метод требует подачи большого импульса тока через пипетку. Величина приложенного тока и длительность импульса также зависят от типа ячейки. Для некоторых типов клеток удобно применять оба метода одновременно, чтобы сломать пластырь.
Преимущество записи с фиксацией на всей ячейке перед записью с использованием метода острого электрода заключается в том, что большее отверстие на конце электрода с фиксацией метки обеспечивает более низкое сопротивление и, следовательно, лучший электрический доступ к внутренней части ячейки. Недостатком этого метода является то, что, поскольку объем электрода больше, чем объем ячейки, растворимое содержимое внутри ячейки будет медленно заменяться содержимым электрода. Это называется электродом, «диализирующим» содержимое ячейки. Через некоторое время любые свойства клетки, зависящие от растворимого внутриклеточного содержимого, изменятся. Используемый пипеточный раствор обычно приближается к среде с высоким содержанием калия внутри ячейки, чтобы минимизировать любые изменения, которые это может вызвать. Часто в начале записи всей клетки есть период, когда можно провести измерения до того, как клетка будет диализована.
Патч снаружи
Название «снаружи-наружу» подчеркивает как взаимодополняемость этой техники с техникой изнутри-наружу, так и тот факт, что она размещает внешнюю, а не внутриклеточную поверхность клеточной мембраны на внешней стороне пластыря мембраны по отношению к пластырю-электроду. .
Формирование патча наружу начинается с конфигурации записи всей клетки. После того, как цельноклеточная конфигурация сформирована, электрод медленно вынимается из клетки, позволяя пузырю мембраны вырваться из клетки. Когда электрод отодвинут достаточно далеко, пузырек отсоединится от ячейки и превратится в выпуклую мембрану на конце электрода (как шар, открытый на кончике электрода), причем исходная часть мембраны будет обращена наружу от электрода. электрод. Как показано на изображении справа, это означает, что жидкость внутри пипетки будет имитировать внутриклеточную жидкость, в то время как исследователь может перемещать пипетку и пузырек с его каналами в другую ванну с раствором. Хотя в пузыре мембраны может существовать несколько каналов, запись по одному каналу также возможна в этой конформации, если пузырек отслоившейся мембраны небольшой и содержит только один канал.
Патч снаружи дает экспериментатору возможность исследовать свойства ионного канала, когда он изолирован от клетки и подвергается последовательному воздействию различных растворов на внеклеточной поверхности мембраны. Экспериментатор может перфузировать один и тот же пластырь различными растворами за относительно короткий промежуток времени, и если канал активируется нейротрансмиттером или лекарством с внеклеточного лица, тогда может быть получена кривая доза-ответ . Эта способность измерять ток через один и тот же кусок мембраны в разных растворах является явным преимуществом внешнего пластыря по сравнению с методом прикрепления клеток. С другой стороны, сделать это труднее. Более длительный процесс формирования включает в себя больше шагов, которые могут потерпеть неудачу, и приводит к меньшей частоте используемых исправлений.
Перфорированная нашивка
Этот вариант метода патч-зажима очень похож на цельноклеточную конфигурацию. Основное различие заключается в том, что, когда экспериментатор формирует гигаомное уплотнение, отсасывание не используется для разрыва заплаты мембраны. Вместо этого электродный раствор содержит небольшие количества противогрибкового или антибиотического агента, такого как амфотерицин-B , нистатин или грамицидин , который диффундирует в пластырь мембраны и образует небольшие поры в мембране, обеспечивая электрический доступ внутрь клетки. Сравнивая методы цельноклеточного и перфорированного пластыря, можно думать о цельноклеточном пластыре как об открытой двери, в которой происходит полный обмен между молекулами в растворе пипетки и цитоплазмой. Перфорированный пластырь можно сравнить с дверцей экрана, которая обеспечивает обмен только определенных молекул из раствора пипетки в цитоплазму клетки.
Преимущества метода перфорированного пластыря по сравнению с записями целых клеток включают свойства пор антибиотика, которые позволяют уравновешивать только небольшие одновалентные ионы между пипеткой-пластырем и цитозолем, но не более крупные молекулы, которые не могут проникать через поры. Это свойство поддерживает эндогенные уровни двухвалентных ионов, таких как Ca 2+, и сигнальных молекул, таких как цАМФ . Следовательно, можно иметь записи всей клетки, как при зажимании участка целой клетки, при сохранении большинства внутриклеточных сигнальных механизмов, как в записях, прикрепленных к клеткам. В результате сокращается текущая перегрузка, а стабильная запись перфорированных патчей может длиться более одного часа. К недостаткам относится более высокое сопротивление доступу по сравнению с целой ячейкой из-за того, что частичная мембрана занимает кончик электрода. Это может снизить текущее разрешение и увеличить шум при записи. Также может потребоваться значительное время, чтобы антибиотик пробил мембрану (около 15 минут для амфотерицина-B и даже больше для грамицидина и нистатина). Мембрана под наконечником электрода ослаблена отверстиями, образованными антибиотиком, и может разорваться. Если пластырь разрывается, запись выполняется в режиме целой клетки, при этом антибиотик заражает внутреннюю часть клетки.
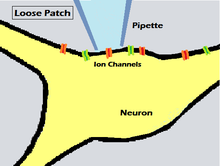
Свободный патч
Свободный зажимной пластырь отличается от других обсуждаемых здесь технологий тем, что в нем используется неплотное уплотнение (низкое электрическое сопротивление), а не плотный гигабайт, используемый в традиционной технике. Этот метод использовался еще в 1961 году, как описано в статье Стрикхольма об импедансе поверхности мышечной клетки, но не получил особого внимания до тех пор, пока не был вновь использован и назван Альмерсом, Стэнфилдом и Штюмером в 1982 году. после того, как патч-зажим стал основным инструментом электрофизиологии.
Чтобы получить свободный патч-зажим на клеточной мембране, пипетка медленно перемещается по направлению к ячейке, пока электрическое сопротивление контакта между ячейкой и пипеткой не возрастет до в несколько раз большего сопротивления, чем сопротивление одного электрода. Чем ближе пипетка подходит к мембране, тем больше становится сопротивление наконечника пипетки, но если слишком близко, образуется уплотнение, и может стать трудно удалить пипетку, не повредив ячейку. Для техники «рыхлого пластыря» пипетка не приближается к мембране достаточно близко, чтобы образовать гигазальное или постоянное соединение, а также не проткнуть клеточную мембрану. Клеточная мембрана остается неповрежденной, а отсутствие плотного уплотнения создает небольшой зазор, через который ионы могут выходить за пределы клетки, не попадая в пипетку.
Существенным преимуществом неплотного уплотнения является то, что используемую пипетку можно многократно снимать с мембраны после записи, и при этом мембрана останется неповрежденной. Это позволяет проводить повторные измерения в различных местах одной и той же ячейки без нарушения целостности мембраны. Эта гибкость была особенно полезна исследователям для изучения мышечных клеток, когда они сокращаются в реальных физиологических условиях, для быстрого получения записей и при этом не прибегая к радикальным мерам, чтобы остановить сокращение мышечных волокон. Основным недостатком является то, что сопротивление между пипеткой и мембраной значительно снижается, что позволяет току течь через уплотнение и значительно снижает разрешение малых токов. Однако эту утечку можно частично исправить, что дает возможность сравнивать и противопоставлять записи, сделанные из разных областей на интересующей ячейке. Исходя из этого, было подсчитано, что метод свободной коммутации может разрешить токи менее 1 мА / см 2 .
Автоматический зажим патч
Автоматизированные системы фиксации заплат были разработаны для недорогого сбора больших объемов данных за более короткий период времени. Такие системы обычно включают одноразовое микрожидкостное устройство, отлитый под давлением или литой чип из полидиметилсилоксана (PDMS), для захвата ячейки или ячеек, а также интегрированный электрод.
В одной из форм такой автоматизированной системы используется перепад давления, чтобы заставить изучаемые клетки тянуться к отверстию пипетки до тех пор, пока они не образуют гигазу. Затем при кратковременном воздействии на кончик пипетки атмосферы часть мембраны, выступающая из пипетки, лопается, и теперь мембрана находится в вывернутой наизнанку конформации на кончике пипетки. В полностью автоматизированной системе пипетка и мембранный пластырь могут затем быстро перемещаться через серию различных тестовых растворов, что позволяет наносить различные тестируемые соединения на внутриклеточную сторону мембраны во время записи.