Стерильный альфа-мотив - Sterile alpha motif
| SAM домен (стерильный альфа-мотив) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||
| Условное обозначение | SAM_1 | ||||||||||
| Pfam | PF00536 | ||||||||||
| ИнтерПро | IPR001660 | ||||||||||
| УМНЫЙ | СЭМ | ||||||||||
| SCOP2 | 1b0x / SCOPe / SUPFAM | ||||||||||
| CDD | cd09487 | ||||||||||
| |||||||||||
| Ste50p-SAM | |||||||||
|---|---|---|---|---|---|---|---|---|---|
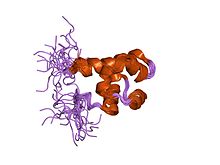 Домен SAM из грибкового белка Ste50p
| |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | Ste50p-SAM | ||||||||
| Pfam | PF09235 | ||||||||
| Клан пфам | CL0003 | ||||||||
| ИнтерПро | IPR015316 | ||||||||
| SCOP2 | 1uqv / SCOPe / SUPFAM | ||||||||
| |||||||||
В молекулярной биологии , то домен белка стерильный альфа - мотив (или САМ ) представляет собой предполагаемую взаимодействие белка модуль присутствует в самых различных белков , участвующих во многих биологических процессах. Домен SAM, охватывающий около 70 остатков, обнаружен у различных эукариотических организмов. Было показано, что SAM-домены гомо- и гетеро-олигомеризуются, формируя множественные архитектуры самоассоциации, а также связываясь с различными белками, не содержащими SAM-домены, тем не менее, с низкой константой сродства.
Домены SAM также, по-видимому, обладают способностью связывать РНК . Smaug , белок, который помогает установить градиент морфогена в эмбрионах дрозофилы путем репрессии трансляции мРНК nanos (nos) , связывается с 3'-нетранслируемой областью (UTR) мРНК nos через две похожие структуры шпильки. Трехмерная кристаллическая структура области связывания РНК Smaug показывает кластер положительно заряженных остатков в домене Smaug-SAM, который может быть поверхностью связывания РНК. Этот электроположительный потенциал является уникальным среди всех ранее определенных структур SAM-домена и сохраняется среди гомологов Smaug-SAM. Эти результаты предполагают, что домен SAM может играть основную роль в связывании РНК.
Структурный анализ показывает, что домен SAM организован в небольшой пучок из пяти спиралей с двумя большими интерфейсами. В случае домена SAM EPHB2 каждый из этих интерфейсов способен образовывать димеры. Присутствие этих двух разных интермономеров связывающей поверхности позволяет предположить, что SAM может образовывать протяженные полимерные структуры.
Грибковый SAM
В молекулярной биологии , то домен белка Ste50p в основном грибы и некоторые другие виды эукариота . Он играет роль в каскадах митоген-активируемых протеинкиназ , типа передачи сигналов клетки, который помогает клетке реагировать на внешние стимулы, в частности на спаривание, рост клеток и устойчивость к осмо у грибов.
Функция
Белковый домен Ste50p играет роль в обнаружении феромонов для спаривания . Считается, что он связан с Ste11p, чтобы продлить индуцированный феромонами сигнальный ответ. Кроме того, он также помогает клетке реагировать на азотное голодание.
Состав
Грибковые Ste50p САМ состоит из шести спиралей , которые образуют компактные, шаровой раз . Это мономер в растворе, который часто подвергается гетеродимеризации (а в некоторых случаях олигомеризации) белка .
Белковое взаимодействие
SAM-домен Ste50p часто взаимодействует с SAM-доменом Ste11p. Они образуют связи через эту ассоциацию. Важно отметить, что домен SAM одного белка будет связываться с SAM другого белка. Домены SAM не связываются самостоятельно in vitro. Имеются значительные доказательства олигомеризации Ste50p in vivo.
Белки человека, содержащие этот домен
ANKS1A ; ANKS1B ; АНКС3 ; ANKS4B ; АНКС6 ; BFAR ; BICC1 ; CASKIN1 ; CASKIN2 ; CENTD1 ; CNKSR2 ; CNKSR3 ; DDHD2 ; EPHA1 ; EPHA10 ; EPHA2 ; EPHA5 ; EPHA6 ; EPHA7 ; EPHA8 ; EPHB1 ; EPHB2 ; EPHB3 ; EPHB4 ; FAM59A ; HPH2 ; INPPL1 ; L3MBTL3 ; PHC1 ; PHC2 ; PHC3 ; PPFIA1 ; PPFIA2 ; PPFIA3 ; PPFIA4 ; PPFIBP1 ; PPFIBP2 ; SAMD1 ; SAMD13 ; SAMD14 ; SAMD3 ; SAMD4A ; SAMD4B ; SAMD5 ; SAMD7 ; SAMD8 ; SAMD9 ; SCMH1 ; SCML1 ; SCML2 ; SEC23IP ; SGMS1 ; SHANK1 ; SHANK2 ; SHANK3 ; STARD13 ; УБП1 ; УШ1Г ; ZCCHC14 ; p63 ; p73 ;
использованная литература
Структурная эволюция p53, p63 и p73: влияние на образование гетеротетрамера
