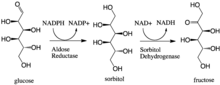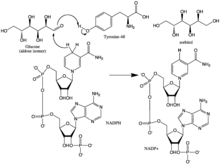Альдозоредуктаза - Aldose reductase
| Альдозоредуктаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Ленточная диаграмма альдозоредуктазы человека в комплексе с НАДФ + , цитратом и IDD594, низкомолекулярным ингибитором . Из PDB : 1us0 .
| |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.1.1.21 | ||||||||
| Количество CAS | 9028-31-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
В энзимологии , альдозоредуктазы (или альдегид - редуктазы ) ( ЕС 1.1.1.21 ) является цитозольного НАДФН -зависимой оксидоредуктазы , что катализирует восстановление различных альдегидов и карбонильных соединений , в том числе моносахаридов. Он известен прежде всего тем, что катализирует восстановление глюкозы до сорбита , первого шага в полиольном пути метаболизма глюкозы.
Реакции
Альдозоредуктаза катализирует НАДФН-зависимое превращение глюкозы в сорбит , первую ступень полиольного пути метаболизма глюкозы. Второй и последний этап этого пути катализируется сорбитолдегидрогеназой , которая катализирует NAD-связанное окисление сорбита до фруктозы. Таким образом, путь полиола приводит к превращению глюкозы во фруктозу со стехиометрическим использованием NADPH и выработкой NADH.
Галактоза также является субстратом для пути полиола, но соответствующий кетосахар не вырабатывается, поскольку сорбитолдегидрогеназа не способна окислять галактит. Тем не менее, альдозоредуктаза может катализировать восстановление галактозы до галактита.
- галактоза + НАДФН + Н + галактитол + НАДФ +
Функция
Реакция альдозоредуктазы, в частности продуцируемого сорбита, важна для функционирования различных органов тела. Например, его обычно используют в качестве первого шага в синтезе фруктозы из глюкозы; второй этап - окисление сорбита до фруктозы, катализируемое сорбитолдегидрогеназой . Основной путь от глюкозы до фруктозы ( гликолиз ) включает фосфорилирование глюкозы гексокиназой с образованием глюкозо-6-фосфата с последующей изомеризацией до фруктозо-6-фосфата и гидролизом фосфата, но путь сорбитола полезен, потому что он не требует ввода от энергии в виде АТФ :
- Семенные пузырьки : фруктоза, произведенная из сорбита, используется сперматозоидами .
- Печень : фруктоза, полученная из сорбита, может использоваться в качестве источника энергии для гликолиза и гликонеогенеза .
Альдозоредуктаза также присутствует в хрусталике , сетчатке , шванновских клетках периферических нервов, плаценте и красных кровяных тельцах .
У дрозофилы CG6084 кодирует высококонсервативный белок человеческой альдокеторедуктазы 1B. dAKR1B в гемоцитах необходим и достаточен для увеличения содержания сахарных спиртов в плазме после кишечной инфекции. Повышенный уровень сорбита впоследствии активировал металлопротеиназу 2, которая расщепляет PGRP-LC, чтобы активировать системный иммунный ответ в жировых телах. Таким образом, альдозоредуктаза обеспечивает критическую метаболическую контрольную точку в общем воспалительном ответе.
Структура фермента
Альдозоредуктазу можно рассматривать как прототип фермента суперсемейства ферментов альдокеторедуктазы. Фермент состоит из 315 аминокислотных остатков и складывается в структурный мотив β / α-цилиндра, состоящий из восьми параллельных β-цепей. Соседние нити соединены восемью периферийными α-спиральными сегментами, идущими антипараллельно β-листу. Каталитический активный центр расположен в ядре цилиндра. Кофактор НАДФН расположен в верхней части бочки β / α, при этом никотинамидное кольцо выступает вниз в центре цилиндра, а пирофосфат охватывает кромку цилиндра.


Ферментный механизм
Механизм реакции альдозоредуктазы в направлении восстановления альдегида следует последовательному упорядоченному пути, по которому связывается НАДФН, за которым следует субстрат. Связывание НАДФН вызывает конформационное изменение (Фермент • НАДФН → Фермент * • НАДФН), которое включает петлеобразное движение поверхностной петли (остатки 213-217), чтобы покрыть часть НАДФН аналогично тому, как это происходит у ремень безопасности. Спиртовой продукт образуется в результате переноса про-R гидрида НАДФН на поверхность карбонильного углерода субстрата. После высвобождения спиртового продукта происходит другое конформационное изменение (E * • NADP + → E • NADP + ) для высвобождения NADP + . Кинетические исследования показали, что переориентация этой петли для высвобождения NADP +, по- видимому, представляет собой лимитирующую стадию в направлении восстановления альдегида. Поскольку скорость высвобождения кофермента ограничивает каталитическую скорость, можно видеть, что нарушение взаимодействий, стабилизирующих связывание кофермента, может иметь драматические эффекты на максимальную скорость (Vmax).
Гидрид, который переносится от НАДФ + к глюкозе, происходит от С-4 никотинамидного кольца в основании гидрофобной полости. Таким образом, положение этого углерода определяет активный центр фермента. В ферменте существуют три остатка на подходящем расстоянии от C-4, которые могут быть потенциальными донорами протонов: Tyr-48, His-110 и Cys-298. Данные эволюционного, термодинамического и молекулярного моделирования предсказывают, что Tyr-48 является донором протонов. Это предсказание подтвердили результаты исследований мутагенеза. Таким образом, считается, что [связывающее водород] взаимодействие между фенольной гидроксильной группой Tyr-48 и боковой цепью аммония Lys-77 способствует облегчению переноса гидрида.
Роль в диабете
Сахарный диабет признан ведущей причиной новых случаев слепоты и связан с повышенным риском болезненной невропатии, болезней сердца и почечной недостаточности. Было выдвинуто множество теорий, объясняющих механизмы, приводящие к диабетическим осложнениям, включая стимуляцию метаболизма глюкозы полиольным путем. Кроме того, фермент находится в глазу ( роговица , сетчатка , хрусталик ), почках и миелиновой оболочке - тканях, которые часто вызывают диабетические осложнения. В нормальных гликемических условиях только небольшая часть глюкозы метаболизируется через полиоловый путь, так как большая часть фосфорилируется гексокиназой, и полученный продукт, глюкозо-6-фосфат, используется в качестве субстрата для гликолиза или метаболизма пентозофосфата. Однако в ответ на хроническую гипергликемию, обнаруживаемую у диабетиков, поток глюкозы через полиоловый путь значительно увеличивается. До 33% общего использования глюкозы в некоторых тканях может происходить через полиоловый путь. У диабетиков часто повышается концентрация глюкозы, и долгое время считалось, что альдозоредуктаза ответственна за диабетические осложнения, затрагивающие ряд органов. Многие ингибиторы альдозоредуктазы были разработаны в качестве кандидатов в лекарственные средства, но практически все они оказались безуспешными, хотя некоторые, такие как эпалрестат , коммерчески доступны в нескольких странах. Дополнительные ингибиторы редуктазы, такие как ранирестат , поналрестат , риналрестат , ризарестат , сорбинил и берберин , в настоящее время проходят клинические испытания.
Смотрите также
Рекомендации
дальнейшее чтение
- Дениз Р., доктор философии. Феррье (2005). Иллюстрированные обзоры Липпинкотта: биохимия (Иллюстрированные обзоры Липпинкотта) . Хагерстаун, Мэриленд: Липпинкотт Уильямс и Уилкинс. п. 319. ISBN 0-7817-2265-9 .
- Attwood MA, Doughty CC (декабрь 1974 г.). «Очистка и свойства альдозоредуктазы печени теленка». Биохим. Биофиз. Acta . 370 (2): 358–68. DOI : 10.1016 / 0005-2744 (74) 90097-7 . PMID 4216364 .
- Богосян Р.А., МакГиннесс ET (апрель 1979 г.). «Аффинная очистка и свойства альдозоредуктазы свиного мозга». Биохим. Биофиз. Acta . 567 (2): 278–86. DOI : 10.1016 / 0005-2744 (79) 90113-X . PMID 36151 .