Автоматизированные системы доставки инсулина - Automated insulin delivery systems
Автоматические системы доставки инсулина - это автоматизированные (или полуавтоматические) системы, предназначенные для помощи людям с диабетом , в первую очередь типа 1, путем автоматической регулировки подачи инсулина, чтобы помочь им контролировать уровень глюкозы в крови . Доступные в настоящее время системы (по состоянию на октябрь 2020 г.) могут доставлять (и регулировать доставку) только одного гормона - инсулина . Другие системы, находящиеся в настоящее время в разработке, нацелены на улучшение существующих систем путем добавления одного или нескольких дополнительных гормонов, которые могут доставляться по мере необходимости, обеспечивая что-то более близкое к эндокринным функциям здоровой поджелудочной железы .
Эндокринная функция поджелудочной железы обеспечивается островковыми клетками, которые вырабатывают гормоны инсулин и глюкагон . Технология искусственной поджелудочной железы имитирует секрецию этих гормонов в кровоток в ответ на изменение уровня глюкозы в крови в организме. Поддержание сбалансированного уровня сахара в крови имеет решающее значение для работы мозга, печени и почек. Следовательно, для пациентов с типом 1 необходимо поддерживать сбалансированный уровень, когда организм сам не может производить инсулин.
Автоматизированные системы доставки инсулина часто называют « искусственной поджелудочной железой» , но у этого термина нет точного, общепринятого определения. Для использования, отличного от автоматической доставки инсулина, см. Искусственная поджелудочная железа (значения) .
Общий обзор
История
Первая автоматизированная система доставки инсулина была известна как Биостатор.
Классы систем AID
Доступные в настоящее время системы AID делятся на четыре широких класса в зависимости от их возможностей. Первые выпущенные системы - системы приостановки - могут только останавливать доставку инсулина. Петлевые системы могут модулировать доставку как вверх, так и вниз.
Пороговая приостановка
Системы пороговой приостановки - это простейшая форма автоматизации доставки инсулина. Они останавливают постоянный поток инсулина из помпы (известный как базальный инсулин), когда подключенный CGM сообщает об уровне глюкозы ниже предварительно установленного порога. Прекращение базальной доставки останавливает нормальную заранее запрограммированную скорость доставки, но не может удалить инсулин, который уже был введен, поэтому общая эффективность пороговых систем приостановки ограничена из-за относительно медленной фармакокинетики инсулина, вводимого подкожно.
Прогнозируемая приостановка с низким уровнем глюкозы
Шаг вперед по сравнению с системами пороговой приостановки, системы прогнозирующей приостановки при низком уровне глюкозы (PLGS) используют математическую модель для экстраполяции прогнозируемых будущих уровней сахара в крови на основе недавних прошлых показаний CGM. Это позволяет системе остановить доставку инсулина за 30 минут до прогнозируемого гипогликемического события, давая дополнительное время для медленной фармакокинетики инсулина, чтобы отразить остановку доставки.
Гибридный замкнутый контур
Гибридные системы с замкнутым контуром (HCL) дополнительно расширяют возможности систем PGLS, регулируя скорость доставки базального инсулина как вверх, так и вниз в ответ на значения от непрерывного монитора глюкозы. Благодаря такой модуляции базального инсулина система способна уменьшить величину и продолжительность как гипергликемических, так и гипогликемических явлений.
Усовершенствованный гибридный замкнутый контур
В дополнение к модуляции базального инсулина, системы Advanced Hybrid Closed Loop могут подавать болюсы инсулина для коррекции повышенного уровня сахара в крови.
Обязательные компоненты
Автоматическая система доставки инсулина состоит из трех отдельных компонентов: непрерывного монитора глюкозы для определения уровня сахара в крови, помпы для доставки инсулина и алгоритма, который использует данные из CGM для отправки команд на помпу. В Соединенных Штатах Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) разрешает каждому компоненту утверждаться независимо, что обеспечивает более быстрые утверждения и дополнительные инновации. Каждый компонент обсуждается более подробно ниже.
Непрерывный монитор глюкозы (CGM)
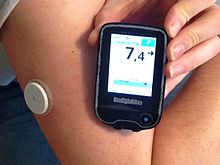
Мониторы непрерывного действия глюкозы (CGM) - это медицинские устройства, которые экстраполируют оценку концентрации глюкозы в крови пациента на основе уровня глюкозы, присутствующей в подкожной интерстициальной жидкости. Тонкий биосовместимый сенсорный провод, покрытый ферментом, реагирующим с глюкозой, вставляется в кожу, позволяя системе считывать генерируемое напряжение и на его основе определять уровень глюкозы в крови. Самым большим преимуществом CGM по сравнению с традиционным глюкометром из пальца является то, что CGM может снимать новые показания каждые 60 секунд (хотя большинство из них снимают показания только каждые 5 минут), обеспечивая частоту отбора проб, которая может обеспечить не только текущий уровень сахара в крови, но и запись прошлых измерений; позволяя компьютерным системам проецировать прошлые краткосрочные тенденции в будущее, показывая пациентам, к чему, вероятно, приведет их уровень сахара в крови.
Ранние CGM не были особенно точными, но все же были полезны для наблюдения и регистрации общих тенденций и обеспечения предупреждений в случае быстрых изменений в показаниях уровня глюкозы в крови.
Мониторы уровня глюкозы в крови непрерывного действия являются одним из набора устройств, которые составляют систему устройства искусственной поджелудочной железы, а вторым является инсулиновая помпа и глюкометр для калибровки устройства. Мониторы непрерывного действия глюкозы - это более недавний прорыв, и они начали появляться на рынке для использования пациентами после одобрения FDA. Как традиционный, так и непрерывный монитор требует ручной подачи инсулина или приема углеводов в зависимости от показаний устройств. В то время как традиционные глюкометры требуют от пользователя укола пальцем каждые несколько часов для получения данных, в непрерывных мониторах используются датчики, расположенные непосредственно под кожей на руке или животе, чтобы передавать данные об уровне сахара в крови на приемники или приложения для смартфонов так часто, как каждые несколько. минут. Датчики можно использовать до четырнадцати дней. Ряд различных мониторов непрерывного действия в настоящее время одобрен FDA.
Первый непрерывный глюкометр (CGM) был одобрен в декабре 2016 года. Разработанная Dexcom мобильная система непрерывного мониторинга G5 требует, чтобы пользователи укололи пальцы дважды в день (в отличие от обычного среднего 8 раз в день с традиционными глюкометрами) по порядку. для калибровки датчиков. Датчики служат до семи дней. Устройство использует технологию Bluetooth, чтобы предупредить пользователя через портативный приемник или приложение на смартфоне, если уровень глюкозы в крови опускается ниже определенного уровня. Стоимость этого устройства без учета совместной страховки составляет около 4800 долларов в год.
FreeStyle Libre CGM от Abbott Laboratories была одобрена в сентябре 2017 года. Недавно технология была изменена для поддержки использования смартфонов через приложение LibreLink. Это устройство вообще не требует уколов пальцами, а датчик, расположенный на плече, работает 14 дней. Ориентировочная стоимость этого монитора составляет 1300 долларов в год.
Следующая модель CGM Dexcom G6 была одобрена в марте 2018 года, она может работать до десяти дней и не требует калибровки пальцем. Как и монитор Medtronic, он может прогнозировать тенденции уровня глюкозы. Он совместим для интеграции с инсулиновыми помпами.
Алгоритм управления
Инсулиновая помпа
Доступные в настоящее время системы
Сделай сам
Коммерческий
MiniMed 670G
В сентябре 2016 года FDA одобрило Medtronic MiniMed 670G , которая была первой одобренной гибридной системой с замкнутым контуром . Устройство определяет потребность диабетика в базальном инсулине и автоматически регулирует его доставку в организм. Он состоит из монитора глюкозы непрерывного действия, инсулиновой помпы и глюкометра для калибровки. Он автоматически изменяет уровень доставки инсулина на основе определения уровня глюкозы в крови непрерывным монитором. Он делает это, отправляя данные об уровне глюкозы в крови через алгоритм, который анализирует и выполняет последующие корректировки. Система имеет два режима. Ручной режим позволяет пользователю выбирать скорость введения базального инсулина. В автоматическом режиме уровень базального инсулина регулируется по показаниям непрерывного монитора каждые пять минут.
Первоначально устройство было доступно только лицам в возрасте 14 лет и старше, а в июне 2018 года оно было одобрено FDA для использования у детей в возрасте 7–14 лет. Семьи сообщают об улучшении качества сна благодаря использованию новой системы, поскольку им не нужно беспокоиться о том, чтобы вручную проверять уровень глюкозы в крови в течение ночи. Полная стоимость системы составляет 3700 долларов США, но пациенты имеют возможность получить ее дешевле.
Системы в разработке
Илет бионическая поджелудочная железа
Команда из Бостонского университета, работающая в сотрудничестве с Массачусетской больницей общего профиля над системой двойного гормона искусственной поджелудочной железы, начала клинические испытания своего устройства под названием Bionic Pancreas в 2008 году. В 2016 году была сформирована Public Benefit Corporation Beta Bionics . В связи с созданием компании Beta Bionics изменила предварительное название своего устройства с Bionic Pancreas на iLet. Устройство использует замкнутую систему для доставки как инсулина, так и глюкагона в ответ на измеренные уровни глюкозы в крови. Прототип iLet 4-го поколения, представленный в 2017 году, еще не утвержден для публичного использования, он размером с iPhone с сенсорным интерфейсом. Он содержит две камеры для инсулина и глюкагона, и устройство можно настроить для использования только с одним гормоном или с обоими. Несмотря на то, что испытания продолжаются, iLet ожидает окончательного утверждения системы, содержащей только инсулин, в 2020 году.
Инреда А.П.
В сотрудничестве с Академическим медицинским центром в Амстердаме Inreda Diabetic BV разработала замкнутую систему с инсулином и глюкагоном. Инициатор, Робин Купс , приступил к разработке устройства в 2004 году и провел первые испытания на себе. В октябре 2016 года Inreda Diabetic BV получила лицензию ISO 13485 , первое требование для производства своей искусственной поджелудочной железы. Сам продукт называется Inreda AP и вскоре прошел несколько весьма успешных испытаний. После клинических испытаний в феврале 2020 года он получил маркировку CE , подтверждающую соответствие европейским нормам.
В октябре 2020 года медицинская страховая компания Menzis and Inreda Diabetic запустила пилотный проект с участием 100 пациентов, застрахованных Menzis. Все эти пациенты сталкиваются с очень серьезными проблемами при регулировании уровня глюкозы в крови. Теперь они используют Inreda AP вместо традиционного лечения. Еще одно крупномасштабное испытание Inreda AP было начато в июле 2021 года и должно определить, должна ли голландская медицинская страховка покрывать устройство для всех застрахованных. Меньшая улучшенная версия Inreda AP планируется выпустить в 2023 году.
Подходы
Медицинское оборудование
Подход с использованием медицинского оборудования включает в себя сочетание монитора глюкозы непрерывного действия и имплантированной инсулиновой помпы, которая может работать вместе с управляемым компьютером алгоритмом для замены нормальной функции поджелудочной железы. Разработка непрерывных мониторов глюкозы привела к прогрессу в технологии искусственной поджелудочной железы с использованием этой интегрированной системы.
Замкнутые системы
В отличие от одного датчика непрерывного действия, система с обратной связью не требует ввода данных пользователем в ответ на показания монитора; система монитора и инсулиновой помпы автоматически подает правильное количество гормона, рассчитанное на основе переданных показаний. Система - это то, что составляет устройство искусственной поджелудочной железы.
Текущие исследования
Четыре исследования различных систем искусственной поджелудочной железы проводятся начиная с 2017 года и планируются в ближайшем будущем. Проекты финансируются Национальным институтом диабета, болезней органов пищеварения и почек и являются заключительной частью тестирования устройств перед подачей заявки на разрешение на использование. Участники исследований могут жить своей жизнью дома, используя устройства и находясь под удаленным наблюдением за безопасностью, эффективностью и рядом других факторов.
Международное исследование диабета с замкнутым циклом , возглавляемое исследователями из Университета Вирджинии , тестирует систему с замкнутым циклом под названием inControl, которая имеет пользовательский интерфейс для смартфона. 240 человек в возрасте от 14 лет участвуют в течение 6 месяцев.
Годовое испытание под руководством исследователей из Кембриджского университета началось в мае 2017 года, и в нем приняли участие около 150 человек в возрасте от 6 до 18 лет. Изучаемая система искусственной поджелудочной железы использует смартфон и имеет функцию низкого уровня глюкозы для улучшения контроля уровня глюкозы.
Международный диабетический центр в Миннеаполисе, штат Миннесота, в сотрудничестве с Детским медицинским центром Шнайдер в Израиле планируют 6-месячное исследование, которое начнется в начале 2019 года и будет включать 112 подростков и молодых людей в возрасте от 14 до 30 лет. Целью исследования является сравнение нынешней системы Medtronic 670G с новой системой, разработанной Medtronic. В новой системе есть программа, направленная на улучшение контроля уровня глюкозы во время еды, что по-прежнему является большой проблемой в этой области.
Текущее 6-месячное исследование, проводимое командой Bionic Pancreas, началось в середине 2018 года, и в нем приняли участие 312 участников в возрасте 18 лет и старше.
Физиологический

Биотехническая компания Defymed, базирующаяся во Франции, разрабатывает имплантируемое биоискусственное устройство под названием MailPan, которое имеет биосовместимую мембрану с избирательной проницаемостью для инкапсуляции различных типов клеток, включая бета-клетки поджелудочной железы . Имплантация устройства не требует конъюнктивной иммуносупрессивной терапии, поскольку мембрана предотвращает проникновение антител пациента в устройство и повреждение инкапсулированных клеток. После хирургической имплантации лист мембраны будет жизнеспособным в течение многих лет. Клетки, которые удерживает устройство, могут быть получены из стволовых клеток, а не из человеческих доноров, а также могут быть заменены с течением времени с использованием входных и выходных соединений без хирургического вмешательства. Defymed частично финансируется JDRF, ранее известным как Фонд исследований ювенильного диабета, но теперь определяется как организация для всех возрастов и всех стадий диабета 1 типа.
В ноябре 2018 года было объявлено, что Defymed будет сотрудничать с израильской Kadimastem, био-фармацевтической компанией, разрабатывающей регенеративную терапию на основе стволовых клеток, чтобы получить двухлетний грант в размере около 1,47 миллиона долларов на разработку биоискусственного препарата. поджелудочная железа, которая лечит диабет 1 типа. Технология стволовых клеток Kadimastem использует дифференцировку эмбриональных стволовых клеток человека для получения эндокринных клеток поджелудочной железы. К ним относятся бета-клетки, вырабатывающие инсулин, а также альфа-клетки, вырабатывающие глюкагон. Обе клетки располагаются в виде островков, имитирующих структуру поджелудочной железы. Целью партнерства является объединение обеих технологий в биоискусственном устройстве поджелудочной железы, которое высвобождает инсулин в ответ на уровень глюкозы в крови, чтобы довести его до стадии клинических испытаний.
Биотехнологическая компания ViaCyte из Сан-Диего, штат Калифорния, также разработала продукт, призванный предоставить решение для лечения диабета 1 типа, в котором используется устройство для инкапсуляции, изготовленное из полупроницаемой мембраны, защищающей от иммунных реакций. Устройство содержит клетки-предшественники поджелудочной железы , которые были дифференцированы от эмбриональных стволовых клеток. После хирургической имплантации в амбулаторных условиях клетки созревают в эндокринные клетки, которые образуют островковые кластеры и имитируют функцию поджелудочной железы, вырабатывая инсулин и глюкагон. Технология продвинулась от доклинических исследований до утверждения FDA для фазы 1 клинических испытаний в 2014 году, а в июне 2018 года были представлены данные за два года. Они сообщили, что их продукт под названием PEC-Encap до сих пор является безопасным и надежным. переносится пациентами в дозах ниже терапевтических. Инкапсулированные клетки были способны выживать и созревать после имплантации, а отторжение иммунной системой уменьшалось благодаря защитной мембране. На втором этапе испытания оценивается эффективность продукта. ViaCyte также получает финансовую поддержку от JDRF в этом проекте.
Инициативы по всему миру
В Соединенных Штатах в 2006 году JDRF (бывший Фонд исследований ювенильного диабета) запустил многолетнюю инициативу, чтобы помочь ускорить разработку, одобрение регулирующих органов и принятие технологии непрерывного мониторинга глюкозы и искусственной поджелудочной железы.
Массовые усилия по созданию и коммерциализации полностью автоматизированной системы искусственной поджелудочной железы также исходили непосредственно от защитников интересов пациентов и диабетического сообщества. Компания Bigfoot Biomedical , основанная родителями детей с СД1, создала алгоритмы и разрабатывает устройство с замкнутым циклом, которое контролирует уровень сахара в крови и соответствующим образом подает инсулин.
использованная литература
- Blauw, H .; и другие. (2020), «Клиническая проверка бигормональной искусственной поджелудочной железы», Diabetes Technology & Therapeutics , Mary Ann Liebert, INC 140 Huguenot Street, 3RD FL, NEW ROCHELLE, NY 10801 USA, 22 : A36-A37