Додекаэдран - Dodecahedrane

|
|||
|
|
|||
| Имена | |||
|---|---|---|---|
|
Имена ИЮПАК
(C 20 - I h ) [5] фуллеран
гексадекагидро-1,6,5,2,4,3- (эпибутан [1,1,2,3,4,4] гексил) дипенталено [2,1,6- gha : 2 ', 1', 6'- cde ] пентален |
|||
| Идентификаторы | |||
|
3D модель ( JSmol )
|
|||
| ЧЭБИ | |||
| ChemSpider | |||
|
PubChem CID
|
|||
| UNII | |||
|
Панель управления CompTox ( EPA )
|
|||
|
|||
|
|||
| Характеристики | |||
| С 20 Ч 20 | |||
| Молярная масса | 260,380 г · моль -1 | ||
| Температура плавления | 430 ± 10 ° С | ||
| Родственные соединения | |||
|
Связанные углеводороды
|
Кубанский тетраэдран Пагодан (изомер додекаэдрана) Присман |
||
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|||
|
|
|||
| Ссылки на инфобоксы | |||
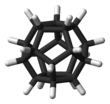
Додекаэдран - это химическое соединение , углеводород с формулой C
20ЧАС
20, атомы углерода которого расположены в виде вершин (углов) правильного додекаэдра . Каждый углерод связан с тремя соседними атомами углерода и с атомом водорода . Это соединение является одним из трех возможных платоновых углеводородов , два других - кубан и тетраэдран .
Додекаэдран не встречается в природе и не имеет значительного использования. Он был синтезирован Лео Пакеттом в 1982 году, в первую очередь для «эстетически приятной симметрии додекаэдрического каркаса».
В течение многих лет додекаэдран был простейшей реальной молекулой на основе углерода с полной икосаэдрической симметрией . Бакминстерфуллерен ( C
60), обнаруженный в 1985 году, также имеет такую же симметрию, но содержит в три раза больше атомов углерода и на 50% больше атомов в целом. Синтез С 20 фуллерена C
20в 2000 г. из бромированного додекаэдрана, возможно, понизил статус C
20ЧАС
20 на второе место.
Структура
Угол между связями CC в каждом атоме углерода составляет 108 °, что представляет собой угол между соседними сторонами правильного пятиугольника . Это значение весьма близко к 109,5 ° центрального угла в виде правильного тетраэдра -The идеально подходит угол между связями на атоме , который имеет (SP 3 гибридизации . В результате, существует минимальный угол деформация . Тем не менее, молекула имеет значительные уровни деформация кручения в результате затменной конформации вдоль каждого края конструкции.
Молекула имеет идеальную икосаэдрическую (I h ) симметрию , о чем свидетельствует ее протонный ЯМР- спектр, в котором все атомы водорода появляются при одном химическом сдвиге 3,38 м.д. В отличие от бакминстерфуллерена, додекаэдран не имеет делокализованных электронов и, следовательно, не имеет ароматичности .
История
Более 30 лет несколько исследовательских групп активно занимались полным синтезом додекаэдрана. В обзорной статье, опубликованной в 1978 году, были описаны различные стратегии, существовавшие до того времени. Первая попытка была предпринята в 1964 году Р. Б. Вудвордом с синтеза соединения трихинацена, который, как считалось, способен просто димеризоваться до додекаэдрана. В гонке участвовали и другие группы, например, Филип Итон и Пол фон Раге Шлейер .
Группа Лео Пакета в Университете штата Огайо была первой, кому удалось пройти сложный 29-шаговый маршрут, который в основном строит додекаэдрический скелет по одному кольцу за раз и, наконец, закрывает последнюю дыру.
В 1987 году группа Хорста Принцбаха нашла более универсальный альтернативный путь синтеза . Их подход был основан на пагодане изомеризации , полученном из изодрина в качестве исходного материала, в том числе посредством [6 + 6] фотоциклоприсоединения . Шлейер придерживался аналогичного подхода в своем синтезе адамантана .
Следуя этой идее, совместные усилия команды Prinzbach и группы Schleyer увенчались успехом, но в лучшем случае получили только 8% доходности по конверсии. В следующее десятилетие группа значительно оптимизировала этот маршрут, так что додекаэдран можно было получить в количествах, составляющих несколько граммов. Новый путь также упростил получение производных с выбранными замещениями и ненасыщенными углерод-углеродными связями . Двумя значительными событиями были открытие σ-бисомоароматичности и образование фуллерена C 20 из высокобромированных додекаэдранов.
Синтез
Исходный маршрут
Органический синтез Пакета в 1982 году включает около 29 этапов с исходным циклопентадиеном (2 эквивалента 10 атомов углерода), диметилацетилендикарбоксилатом (4 атома углерода) и аллилтриметилсиланом (2 эквивалента, 6 атомов углерода).
В первой части процедуры две молекулы циклопентадиена 1 имеют в сочетании друг с другом посредством реакции с элементарной натрия (образуя циклопентадиенил комплекс ) и йод в dihydrofulvalene 2 . Далее идет тандемная реакция Дильса-Альдера с диметилацетилендикарбоксилатом 3 с желаемой последовательностью пентадиен-ацетилен-пентадиен, как в симметричном аддукте 4 . Равное количество асимметричного соединения пентадиен-пентадиен-ацетилен ( 4b ) образуется и выбрасывается.
На следующем этапе последовательности йод временно вводят посредством йодолактонизации двухосновной кислоты 4 до дилактона 5 . Эфира группа расщепляются рядом с метанолом в галогенгидрину 6 , то спирт группа превращает в кетон группу в 7 пути Jones окисления и группами йода уменьшенных на цинк-медную пару в 8 .
Последние 6 атомов углерода вводятся путем нуклеофильного присоединения к кетонным группам карбаниона 10, образованного из аллилтриметилсилана 9 и н- бутиллития . На следующем шаге винилсилан 11 вступает в реакции с надуксусной кислотой в уксусной кислоте в радикальном замещении к dilactone 12 с последующим внутримолекулярным Фриделем-Крафтс алкилирование с пентоксидом фосфор до дикетона 13 . Эта молекула содержит все необходимые 20 атомов углерода, а также симметрична, что облегчает построение оставшихся 5 углерод-углеродных связей .
Снижение из двойных связей в 13 до 14 осуществляется с гидрированием с палладием на угле , и что из кетоновых групп в спиртовые группы в 15 с помощью боргидрида натрия . Замена гидроксила хлором в 17 посредством нуклеофильного алифатического замещения происходит через дилактон 16 ( тозилхлорид ). Первая реакция образования связи C – C представляет собой разновидность алкилирования березы ( литий , аммиак ) с улавливанием продукта немедленной реакции хлорметилфениловым эфиром , другой атом хлора в 17 просто восстанавливается. Это временное приложение на более позднем этапе предотвратит нежелательную енолизацию . Вновь образованный кетон Затем группа образует другую связь С-С с помощью фотохимического Norrish реакции на 19 , чью спиртовой группа индуцируются устранить с помощью TsOH в алкенные 20 .
Двойная связь восстанавливается гидразином и последовательным восстановлением гидрида диизобутилалюминия, а окисление хлорхроматом пиридиния 21 образует альдегид 22 . Вторая реакция Норриша затем добавляет еще одну связь C – C к спирту 23, и, выполняя свою задачу, фенокси-хвост удаляется в несколько этапов: восстановление по Берчу до диола 24 , окисление хлорхроматом пиридиния до кетоальдегида 25 и обратная конденсация Клайзена до кетона 26 . Третья реакция Норриша дает спирт 27, вторая дегидратация 28 и еще одно восстановление 29, после чего синтез полностью прекращается без функциональных групп . Отсутствующая связь CC восстанавливается дегидрированием под давлением водорода с палладием на угле при 250 ° C до додекаэдрана 30 .
Пагоданский маршрут
В оптимизированном маршруте Принцбаха от пагодана до додекаэдрана исходная низкоурожайная изомеризация родительского пагодана до додекаэдрана заменяется более длинной, но более высокопродуктивной последовательностью, которая, тем не менее, все еще сильно зависит от производных пагодана. На схеме ниже отклонение от оригинала происходит после соединения 16.
Производные
Различные производные додекаэдрана были синтезированы и описаны в литературе.
Замещение водорода
Замена всех 20 атомов водорода на атомы фтора дает относительно нестабильный перфтородекаэдран C 20 F 20 , который был получен в миллиграммах. Следовые количества аналогичного перхлородекаэдрана C 20 Cl 20 были получены, среди других частично хлорированных производных, путем взаимодействия C
20ЧАС
20растворяется в жидком хлоре под давлением при температуре около 140 ° C и при ярком свете в течение пяти дней. Полная замена более тяжелыми галогенами кажется все более сложной задачей из-за их большего размера. Половина или более атомов водорода могут быть замещены гидроксильными группами с образованием полиолов , но крайнее соединение C 20 (OH) 20 оставалось неуловимым по состоянию на 2006 год. Были получены амино-додекаэдраны, сравнимые с амантадином , но они были более токсичными и более слабыми. противовирусные эффекты.
Предложены аннелированные додекаэдровые структуры.
Инкапсуляция
Молекулы, каркас которых образует замкнутую клетку, такие как додекаэдран и бакминстерфуллерен, могут заключать атомы и небольшие молекулы в пустое пространство внутри. Эти вставки не связаны химически с компаундом каркаса, а просто механически удерживаются в нем.
Кроссу, Сондерсу и Принцбаху удалось заключить атомы гелия в додекаэдран, стреляя ионами He + в пленку соединения. Они получили микрограммовые количества He @ C
20ЧАС
20(«@» - стандартное обозначение инкапсуляции), которое они описали как довольно стабильное вещество. Молекула была описана как «самый маленький гелиевый шар в мире ».