Анионный канал с регулируемым объемом - Volume-regulated anion channel
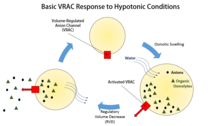
Анионные каналы с регулируемым объемом ( VRAC ) имеют решающее значение для регуляции размера клеток за счет транспортировки ионов хлора и различных органических осмолитов , таких как таурин или глутамат , через плазматическую мембрану , и это не единственная функция, с которой связаны эти каналы. Некоторые исследования также показали, что VRAC также могут быть водопроницаемыми.
Регулирование объема клеток необходимо не только для предотвращения набухания или сжатия, вызванного изменением окружающей среды клетки, но и на всех этапах жизни клетки. Изменение объема клетки, будь то набухание или сжатие, обычно происходит без серьезных изменений, таких как внедрение экзоцитов или извлечение эндоцитов плазматической мембраны. Вместо этого регулирование объема в основном происходит за счет транспорта калия, натрия, хлорида и органических осмолитов через мембрану. Последствия того, что клетки не могут регулировать размер своего объема по отношению к окружающей среде, велики, поскольку набухание приводит к лизису , а сокращение в конечном итоге приводит к обезвоживанию и апоптозу . Специфическая роль, которую VRACs играют в регуляции клеточного объема, - это регуляторное уменьшение объема (RVD) клеток.
Исследования VRACs привели некоторых к выводу, что они широко экспрессируются в клетках млекопитающих и даже могут экспрессироваться повсеместно. Было также показано, что VRAC участвуют в фундаментальных клеточных процессах, отличных от регуляции основного объема, таких как пролиферация , миграция и апоптоз клеток .
Устройство и механизм
Хотя научному сообществу известно о VRAC уже давно, только недавно было обнаружено, каков молекулярный состав каналов. Они состоят из гетеромеров белка LRRC8 , из которых существует пять разновидностей. Однако конкретный состав LRRC8A , LRRC8B , LRRC8C , LRRC8D и LRRC8E, необходимый для правильного функционирования VRAC, неизвестен. Один только LRRC8A может образовывать гексамерный VRAC, для которого структура cyro-EM была определена в его версиях для мышей и человека.
Исследования также показали, что вариации в составе субъединиц приводят к вариациям в способности VRAC переносить определенные метаболиты . Например, субъединица LRRC8D , участвующая в составе VRAC, была тесно связана с транспортом таурина вместе со специфическими противораковыми препаратами. Благодаря подобным экспериментам мы знаем, что вполне вероятно, что белки LRRC8 также создают поры VRAC.
Что касается механизма для VRAC, недавние исследования показали, что они активируются, когда происходит снижение внутриклеточной ионной силы, что означает, что VRAC могут также действовать как сенсоры, а также влиять на регуляцию клеточного объема. Однако исследователям не удалось найти какие-либо внутриклеточные сигнальные механизмы, которые играют доминирующую роль в активации VRAC.
Трансмембранная часть белков LRRC8 аналогична таковой у паннексинов .
Роли в нейронах
VRAC имеют решающее значение для транспорта не только хлорида, но также таурина , глутамата и аспартата . Эти органические осмолиты важны не только для регуляции клеточного объема, но и для внеклеточной передачи сигналов. Чтобы подготовить почву для роли VRAC во внеклеточной передаче сигналов, мы должны обсудить некоторые последствия, которые высвобождение глутамата и таурина из VRAC оказывает на окружающие нейроны соответственно.
Что касается глутамата , когда возбуждающие нейротрансмиттеры высвобождаются и активируют каналы на окружающих нейронах , это приводит к сверхактивной деполяризации и увеличению ионов кальция и, в конечном итоге, к апоптозу клеток . Это обычно называется эксайтотоксичностью и обычно приводит к набуханию нейронов. Высвобождение органических осмолитов VRAC в ответ на это набухание и приток ионов, скорее всего, помогает предотвратить разрыв нейрона , поскольку высвобождение неорганических соединений из клетки было связано только с уменьшением клеточного объема примерно на 20%. 30%. Тем не менее, помимо предотвращения лизиса нейрона, высвобождение таурина и глутамата также будет продолжать распространять эффект эксайтотоксичности на соседние нейроны . Наиболее важными клетками для изучения роли VRAC и реакции на эксайтотоксичность являются астроциты . Это связано с их ролью в качестве сторонников нейронной коммуникации в головном мозге, тем фактом, что они, как было доказано, содержат VRAC, и тем фактом, что они были обнаружены в опухшем состоянии в ответ на патологии, связанные с эксайтотоксичностью . Как мы заявляли, усиление стимуляции нейрона приводит к эксайтотоксичности , а глутамат является одним из нейротрансмиттеров , избыток которых может вызвать этот нейрональный ответ. Этому клеточному ответу приписывают множество патологий, в том числе инсульт и гипогликемию . Например, несколько исследований показали, что активация клеточного VRAC астроцитов может быть связана с повышением уровня таких веществ, как АТФ, связанных с инсультом . Эксперименты показали, что ингибиторы VRAC способны уменьшать вызванное инсультом высвобождение возбуждающих нейромедиаторов в головном мозге; Это означает, что VRACs, вероятно, активируются увеличением клеточного АТФ и других молекул в астроцитах , и высвобождение глутамата этими клетками вызывает деполяризацию нейронов вокруг них, увеличивает их концентрацию ионов кальция и подвергается апоптозу .
Другой органический осмолит , связанный с VRACs, тауриной , также имеет много внеклеточных функций сигнализации. В частности, считается, что высвобождение таурина из глии с помощью VRAC связано с регуляцией системного объема в осмочувствительном супраоптическом ядре (SON). Сначала исследователи думали, что нейроны, обнаруженные в SON, не могут подвергаться RVD, но позже было обнаружено, что они в конечном итоге развивают ток ионов хлора через определенное время. В связи с этим открытием снова были изучены астроциты , и они обнаружили, что клетки легко реагируют на гипертоническую среду, высвобождая таурин через VRAC-подобные каналы. В свою очередь, таурин активирует хлоридные каналы рецептора глицина на соседних нейронах SON, что вызывает их гиперполяризацию . Поскольку нейроны SON сжимаются и деполяризуются в гипертонической среде, это взаимодействие между астроцитами действует как ингибитор секреции вазопрессина с помощью SON.
На основании этих исследований роли VRAC как в условиях эксайтотоксичности, так и в регуляции осмочувствительного супраоптического ядра (SON), есть большое значение для фактического влияния, которое этот канал оказывает на повседневную активность нейронов. Вполне вероятно, что VRAC играют важную роль в регуляции нейронов; однако исследователям трудно сузить диапазон их эффектов. Еще один важный аспект нейронов, о котором следует помнить, - это то, что котранспортеры хлорида калия (KCC) - это другие белки, которые также являются частью процесса RVD и активируются, когда клетки подвергаются набуханию. Это важно иметь в виду, потому что VRAC - не единственные присутствующие молекулы, которые помогают в регулировании объема клеток, и недавние исследования показали, что вероятность того, что эти два канала работают совместно, высока.
Медицинские связи
В дополнение к связям, представленным в обсуждении многих ролей VRAC в нейронах , исследования показали, что сокращение клеток в значительной степени предшествует гибели клеток (известной как AVD - уменьшение апоптического объема), и были исследования, которые показали, что VRAC играют определенную роль. в этом процессе. Вероятно, что ингибирование сокращения клеток связано с ингибиторами VRAC или с общим нарушением белков LRRC8. Это ингибирование или нарушение в конечном итоге приводит к подавлению апоптоза, вызванного лекарственными средствами . Следовательно, VRAC могут играть роль в лекарственной устойчивости при определенных типах рака.
