Синтетаза сукцинилкофермента А - Succinyl coenzyme A synthetase
| Сукцинат — КоА-лигаза (формирующая GDP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 ГТФ-специфическая сукцинил-КоА синтетаза свиньи с ГТФ. PDB 2fp4
| |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 6.2.1.4 | ||||||||
| Количество CAS | 9014-36-2 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | Amigo / QuickGO | ||||||||
| |||||||||
| Сукцинат - КоА-лигаза (АДФ-образующая) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Сукцинил-COA синтетаза из Escherichia coli . PDB 2scu
| |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 6.2.1.5 | ||||||||
| Количество CAS | 9080-33-5 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | Amigo / QuickGO | ||||||||
| |||||||||
Сукцинил-кофермент А-синтетаза ( SCS , также известная как сукцинил-КоА-синтетаза или сукцинаттиокиназа или сукцинат-КоА-лигаза ) - это фермент, который катализирует обратимую реакцию сукцинил-КоА с образованием сукцината . Фермент способствует сочетанию этой реакции с образованием молекулы нуклеозидтрифосфата ( GTP или ATP ) из молекулы неорганического фосфата и молекулы нуклеозиддифосфата ( GDP или ADP ). Он играет ключевую роль в качестве одного из катализаторов цикла лимонной кислоты , центрального пути клеточного метаболизма , и находится в митохондриальном матриксе клетки.
Химическая реакция и механизм фермента
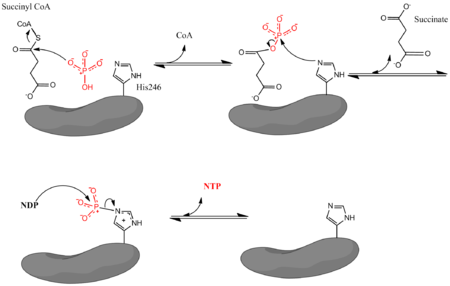
Сукцинил-КоА-синтетаза катализирует следующую обратимую реакцию :
- Сукцинил-КоА + Pi + NDP ↔ сукцинат + CoA + NTP
где Pi обозначает неорганический фосфат, NDP обозначает нуклеозиддифосфат (GDP или ADP), а NTP обозначает нуклеозидтрифосфат (GTP или ATP). Как уже упоминалось, фермент способствует сочетанию превращения сукцинил-КоА в сукцинат с образованием NTP из NDP и Pi. Изменение свободной энергии реакции по биохимическому стандарту составляет -3,4 кДж / моль. Реакция происходит по трехступенчатому механизму, который показан на изображении ниже. Первый этап включает замещение КоА из сукцинил-КоА нуклеофильной молекулой неорганического фосфата с образованием сукцинилфосфата. Затем фермент использует остаток гистидина для удаления фосфатной группы из сукцинилфосфата и образования сукцината. Наконец, фосфорилированный гистидин передает фосфатную группу нуклеозиддифосфату, который генерирует высокоэнергетический нуклеозидтрифосфат.
Структура
Подразделения
SCS бактерий и млекопитающих состоят из субъединиц α и β . В E. coli два гетеродимера αβ соединяются вместе, образуя гетеротетрамерную структуру α 2 β 2 . Однако митохондриальные SCS млекопитающих активны как димеры αβ и не образуют гетеротетрамер. Кишечная палочка гетеротетрамеры ГКС была кристаллизуют и охарактеризованы в деталях. Как видно на изображении 2, две субъединицы α (розовая и зеленая) находятся на противоположных сторонах структуры, а две субъединицы β (желтая и синяя) взаимодействуют в средней области белка. Две α-субъединицы взаимодействуют только с одной β-единицей, тогда как β-единицы взаимодействуют с одной α-единицей (с образованием димера αβ) и β-субъединицей другого αβ-димера. Короткая аминокислотная цепь связывает две субъединицы β, что дает тетрамерную структуру.
Кристаллическая структура из сукцинил-СоА - синтетазы альфа - субъединицу (сукцинил-СоА-связывающий изоформы) была определена Джойс и соавт. с разрешением 2,10 A, с кодом PDB 1CQJ. [1] .
Каталитические остатки
Кристаллические структуры SCS E. coli свидетельствуют о том, что кофермент А связывается внутри каждой α-субъединицы (в пределах складки Россмана ) в непосредственной близости с остатком гистидина (His246α). Этот остаток гистидина фосфорилируется на стадии образования сукцината в механизме реакции. Точное место связывания сукцината точно не определено. Образование нуклеозидтрифосфата происходит в захватном домене АТФ, который расположен около N-конца каждой β-субъединицы. Однако этот домен захвата расположен примерно в 35 Å от остатка фосфорилированного гистидина. Это заставляет исследователей полагать, что фермент должен претерпеть серьезные изменения в конформации, чтобы доставить гистидин к домену захвата и облегчить образование нуклеозидтрифосфата. Эксперименты по мутагенезу показали, что два остатка глутамата (один рядом с каталитическим гистидином, Glu208α и один рядом с захватным доменом АТФ, Glu197β) играют роль в фосфорилировании и дефосфорилировании гистидина, но точный механизм, с помощью которого фермент изменяет конформацию, не определен. полностью понял.
Изоформы
Джонсон и др. описывают две изоформы сукцинил-КоА синтетазы у млекопитающих , одну, которая определяет синтез АДФ , и другую , которая синтезирует GDP .
У млекопитающих фермент представляет собой гетеродимер α- и β-субъединицы. Специфичность как для аденозиновых, так и для гуанозинфосфатов определяется β-субъединицей, которая кодируется 2 генами. SUCLG2 является GTP-специфичным, а SUCLA2 является ATP-специфичным, тогда как SUCLG1 кодирует общую α-субъединицу. β-варианты продуцируются в разных количествах в разных тканях, вызывая потребность в субстрате GTP или ATP .
В большинстве потребляющих тканей, таких как сердце и мозг, больше АТФ-специфической сукцинил-КоА синтетазы (ATPSCS), в то время как синтетические ткани, такие как почки и печень, имеют более GTP-специфическую форму (GTPSCS). Кинетический анализ ATPSCS из грудной мышцы голубей и GTPSCS из печени голубя показал, что их кажущиеся константы Михаэлиса были подобны для CoA, но различались для нуклеотидов, фосфата и сукцината. Наибольшая разница была для сукцината: K m app для ATPSCS = 5 мМ по сравнению с GTPSCS = 0,5 мМ.
Функция
Образование нуклеозидтрифосфатов
SCS - единственный фермент в цикле лимонной кислоты, который катализирует реакцию, в которой нуклеозидтрифосфат (GTP или ATP) образуется в результате фосфорилирования на уровне субстрата . Исследования показали, что SCS E. coli могут катализировать образование GTP или ATP. Однако млекопитающие обладают различными типами SCS, которые специфичны либо для GTP (G-SCS), либо для ATP (A-SCS) и являются нативными для различных типов тканей в организме. Интересное исследование с использованием клеток голубя показало, что GTP-специфические SCS были локализованы в клетках голубиной печени, а ATP-специфические SCS были расположены в клетках грудных мышц голубей. Дальнейшие исследования выявили аналогичный феномен ГТФ и АТФ-специфичных SCS в тканях крыс, мышей и человека. Похоже, что ткани, обычно участвующие в анаболическом метаболизме (например, печень и почки), экспрессируют G-SCS, тогда как ткани, участвующие в катаболическом метаболизме (например, мозг, сердце и мышечная ткань), экспрессируют A-SCS.
Образование промежуточных продуктов метаболизма
SCS облегчает поток молекул в другие метаболические пути , контролируя взаимное превращение между сукцинил-КоА и сукцинатом. Это важно, потому что сукцинил-КоА является промежуточным продуктом, необходимым для биосинтеза порфирина , гема и кетоновых тел .
Регулирование и торможение
У некоторых бактерий фермент регулируется на уровне транскрипции. Было продемонстрировано, что ген SCS (SucCD) транскрибируется вместе с геном α-кетоглутаратдегидрогеназы (SucAB) под контролем промотора, называемого sdhC, который является частью оперона сукцинатдегидрогеназы . Этот оперон активируется присутствием кислорода и реагирует на различные источники углерода. Антибактериальные препараты , предотвращающие фосфорилирование гистидина, такие как молекула LY26650, являются мощными ингибиторами бактериальных SCS.
Оптимальная активность
Измерения (выполненные с использованием SCS соевых бобов) показывают оптимальную температуру 37 ° C и оптимальный pH 7,0-8,0.
Роль в болезни
Смертельный младенческий лактоацидоз: дефектный SCS считается причиной смертельного детского лактоацидоза , заболевания у младенцев, которое характеризуется накоплением токсичных уровней молочной кислоты. Состояние (когда оно наиболее тяжелое) обычно приводит к смерти в течение 2–4 дней после рождения. Было установлено, что пациенты с этим заболеванием обнаруживают делецию двух пар оснований в гене, известном как SUCLG1, который кодирует α-субъединицу SCS. В результате функциональный SCS отсутствует в метаболизме, вызывая серьезный дисбаланс в потоке между гликолизом и циклом лимонной кислоты. Поскольку в клетках отсутствует функциональный цикл лимонной кислоты, возникает ацидоз, поскольку клетки вынуждены выбирать продукцию молочной кислоты в качестве основного средства производства АТФ.
Смотрите также
- Цикл лимонной кислоты
- Сукцинатдегидрогеназа
- Сукцинат - КоА-лигаза (АДФ-образующая)
- Сукцинат — КоА-лигаза (формирующая GDP)
Рекомендации
внешние ссылки
- Сукцинил + коэнзим + A + синтетазы в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)