Токсин трехпалого - Three-finger toxin
| Змеиный токсин и токсиноподобный белок | |||||||||
|---|---|---|---|---|---|---|---|---|---|

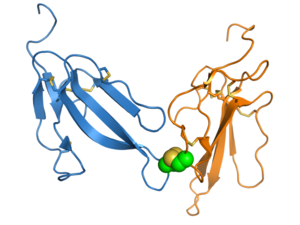
Эрабутоксин А , нейротоксин , входящий в суперсемейство 3FTx. Три «пальца» обозначены I, II и III, а четыре консервативных дисульфидных связи показаны желтым цветом. Оформлено из PDB : 1QKD .
| |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | Toxin_TOLIP | ||||||||
| Pfam | PF00087 | ||||||||
| Клан пфам | CL0117 | ||||||||
| ИнтерПро | IPR003571 | ||||||||
| ПРОФИЛЬ | PS00272 | ||||||||
| CATH | 1qkd | ||||||||
| SCOP2 | 1qkd / SCOPe / SUPFAM | ||||||||
| OPM суперсемейство | 53 | ||||||||
| Белок OPM | 1txa | ||||||||
| CDD | cd00206 | ||||||||
| |||||||||
Токсины три пальцев (сокращенно 3FTx ) представляют собой белка надсемейства малого токсина белков , обнаруженных в яде из змей . Трехпальцевые токсины, в свою очередь, являются членами более крупного суперсемейства трехпальцевых белковых доменов, которое включает нетоксичные белки, которые имеют сходную белковую складку . Группа названа в честь ее общей структуры, состоящей из трех петель бета-цепей, соединенных с центральным ядром, содержащим четыре консервативные дисульфидные связи . Белковый домен 3FP не обладает ферментативной активностью и обычно имеет длину от 60 до 74 аминокислотных остатков . Несмотря на свою консервативную структуру, токсиновые белки с тремя пальцами обладают широким спектром фармакологических эффектов. Большинство членов этого семейства - нейротоксины, которые действуют на холинергическую межклеточную передачу сигналов; что альфа-нейротоксин семья взаимодействует с мышечным никотиновым рецепторами ацетилхолина (nAChRs), в каппа-бунгаротоксине семьей с нейронным nAChRs и мускариновыми токсинами с мускариновыми рецепторами ацетилхолина (mAChRs).
Состав
Суперсемейство токсинов с тремя пальцами определяется общей третичной структурой, состоящей из трех петель, содержащих бета-цепь (обозначенных петлями I, II и III), выступающих из небольшого гидрофобного ядра, содержащего четыре консервативные дисульфидные связи . Считается, что эта структура напоминает руку с тремя пальцами, отсюда и название. Белки обычно состоят из 60-74 аминокислотных остатков , хотя некоторые имеют дополнительные N- или C-концевые удлинения. Дополнительная дисульфидная связь может присутствовать либо в петле I, либо в петле II. Надсемейство можно условно разделить на три класса:
- короткоцепочечные токсины содержат менее 66 остатков и четыре основных дисульфидных связи.
- длинноцепочечные токсины имеют по крайней мере 66 остатков, дисульфидную связь в петле II и, возможно, С-концевое удлинение.
- нетрадиционные токсины имеют дисульфидную связь в петле I и, возможно, концевые удлинения.
Олигомеризация
Большинство белков 3FTx являются мономерами . Однако некоторые подгруппы 3FTx образуют функциональные нековалентные гомодимеры . Группа каппа-бунгаротоксинов является наиболее охарактеризованным димером 3FTx и взаимодействует через антипараллельный интерфейс димеров, состоящий из внешней цепи петли III. Гадитоксин является другим примером димера 3FTx; он является членом короткоцепочечной группы и имеет аналогичный интерфейс димеров, но отличную фармакологию по сравнению с длинноцепочечными каппа-бунгаротоксинами.
Также описано несколько примеров ковалентно связанных димеров. Эти белки из нетрадиционной группы связаны межмолекулярными дисульфидными связями. Некоторые из них, такие как ирдитоксин , представляют собой гетеродимеры, связанные цистеинами в петлях I и II. Другие, такие как альфа-кобротоксин , могут образовывать как гомодимеры, так и гетеродимеры, которые обладают различными фармакологическими активностями in vitro , хотя их функциональное значение неясно из-за их очень низкой концентрации в яде.
Функция
Несмотря на консервативную общую структуру, белки 3FTx обладают широким спектром фармакологических эффектов, опосредующих их токсичность. Многие члены этого семейства являются нейротоксинами, которые связываются с рецепторными белками клеточной мембраны, особенно с никотиновыми рецепторами ацетилхолина . Другие, включая вторую по величине подгруппу 3FTx, относятся к кардиотоксинам .
Сотовые цели
Никотиновые рецепторы ацетилхолина
Многие из наиболее хорошо охарактеризованных белков 3FTx проявляют свои токсические эффекты за счет связывания с никотиновыми рецепторами ацетилхолина (nAChR), семейством лиганд-управляемых ионных каналов . Связывание 3FTx препятствует передаче холинергических межклеточных сигналов, особенно в нервно-мышечных соединениях, и вызывает паралич . Семейство альфа-нейротоксинов представляет собой группу белков 3FTx, которые связывают мышечные nAChR , предотвращая связывание нейромедиатора ацетилхолина . Альфа-бунгаротоксин , альфа-нейротоксин из многополосного крайта ( Bungarus multicinctus ), давно используется в исследованиях молекулярной биологии ; именно благодаря изучению этого токсина были выделены и охарактеризованы nAChR, что облегчило изучение субъединичного состава тканеспецифичных nAChR и детальное фармакологическое понимание нервно-мышечного соединения . В целом, короткоцепочечные 3FTx члены этой группы связывают только мышечные nAChR, а длинноцепочечные члены связывают как мышечные, так и нейрональные рецепторы. Эту группу 3FTx иногда называют «кураремиметическими» токсинами из-за сходства их действия с растительным алкалоидом кураре .
Другие группы белков 3FTx также связываются с разными подтипами nAChR; например, каппа-нейротоксины , которые представляют собой димеры с длинной цепью, связывают нейрональные nAChR, а хадитоксин , который представляет собой димер с короткой цепью, связывает как мышечные, так и нейрональные подтипы. Нетрадиционные белки 3FTx также часто связывают nAChR; При первом открытии считалось, что это более слабые токсины, но было обнаружено, что этот класс обладает целым рядом сродства связывания . Недавно был описан новый класс белков 3FTx-антагонистов nAChR, называемых омега-нейротоксинами.
Мускариновые рецепторы ацетилхолина
Меньший класс белков 3FTx вместо этого связывается с мускариновыми рецепторами ацетилхолина , семейством рецепторов , связанных с G-белками . Мускариновые токсины могут быть либо агонистами рецепторов, либо антагонистами рецепторов , и в некоторых случаях один и тот же белок 3FTx является агонистом одного подтипа рецептора и антагонистом другого. Мускариновые токсины обычно имеют короткоцепочечный тип.
Ацетилхолинэстераза
Класс белков 3FTx, называемых фасцикулинами, связывает фермент ацетилхолинэстеразу и ингибирует его активность, блокируя доступ ацетилхолина к активному центру фермента , тем самым предотвращая распад ацетилхолина. Этот класс получил свое название из-за своего клинического эффекта, вызывающего мышечные фасцикуляции .
Сердечные цели
Второй по величине класс белков 3FTx вызывает токсичность в сердечных миоцитах и может вызывать учащение пульса и, в конечном итоге, остановку сердца . Эти кардиотоксины также часто обладают общим цитотоксическим действием и иногда называются цитолизинами. Белки-мишени в миоцитах этого класса обычно не известны, хотя некоторые члены могут вызывать физическое повреждение клетки, создавая поры в клеточной мембране .
Другой класс, называемый бета-кардиотоксинами , вызывает снижение частоты сердечных сокращений и, как считается, действует как бета-блокаторы , антагонисты бета-1 и бета-2 адренергических рецепторов .
Менее распространенные цели
Известны белки 3FTx, которые нацелены на множество дополнительных белковых мишеней для оказания своих токсических эффектов. Например, кальциептином нацелены кальциевые каналы L-типа, а агрегация тромбоцитов ингибируется за счет взаимодействия с белками адгезии дендроаспином и родственными ему белками. В некоторых случаях не наблюдается токсичности в результате взаимодействия 3FTx-мишень; например, mambalgin семейство белков 3FTx взаимодействует с кислотно-чувствительных ионных каналов для получения анальгезии без видимого токсического эффекта в лабораторных тестах.
Орфанные белки 3FTx
Исследования известных белковых последовательностей , основанные на биоинформатике , часто выявляют ряд последовательностей, которые могут образовывать структуру белка 3FTx, но функция которых не была экспериментально охарактеризована. Таким образом, неизвестно, являются ли эти «сиротские» белки на самом деле токсинами и каковы могут быть их клеточные мишени. Геномические исследования экспрессии генов у змей показали, что члены белковых семейств, традиционно считающихся токсинами, широко экспрессируются в тканях тела змей и что этот паттерн экспрессии происходит за пределами очень ядовитого надсемейства Caenophidia .
Отношения между структурой и функцией деятельности

Поскольку белки 3FTx схожей структуры связывают широкий спектр клеточных белковых мишеней, взаимосвязь между последовательностью белка 3FTx и их биологической активностью широко изучена, особенно среди альфа-нейротоксинов . Известные функциональные сайты, придающие аффинность и специфичность связывания , сосредоточены в петлях белков 3FTx. Например, кристаллическая структура из альфа-бунгаротоксина в комплексе с внеклеточным доменом из альфа-9 нАХР субъединицы указывает на белок-белковое взаимодействие опосредуется через петли I И II, без каких - либо контактов , образованных петли III. Поверхности взаимодействия были нанесены на карту для ряда токсинов и варьируются в зависимости от того, какие петли участвуют в связывании; эрабутоксин A использует все три петли для связывания nAChR, в то время как взаимодействие дендроаспина с белками адгезии опосредуется тремя остатками в петле III. В некоторых белках 3FTx с С-концевым удлинением эти остатки также участвуют в формировании ключевых связывающих взаимодействий.
Подгруппа кардиотоксин / цитолизин 3FTx имеет несколько иной набор функционально значимых остатков из-за своего особого механизма действия, вероятно, включающего взаимодействия с фосфолипидами в клеточной мембране , а также возможные функционально значимые взаимодействия с другими молекулами клеточной поверхности, такими как гликозаминогликаны . Гидрофобным участок остатков смежных в третичной структуре , но распределенных по всем трем петлями был идентифицирован как функционально значимым в сочетании с набором законсервированных лизина остатков , придающих локальный положительный заряд.
Из-за их структурного сходства и функционального разнообразия белки 3FTx использовались в качестве модельных систем для изучения белковой инженерии . Их высокая специфичность связывания с мишенями, представляющими фармакологический интерес, отсутствие ферментативной активности и низкая иммуногенность также вызвали интерес к их потенциалу в качестве ведущих лекарственных средств .
Эволюция
Хотя трехпальцевые белки в целом широко распространены среди многоклеточных животных , трехпальцевые токсины обнаруживаются только у змей . Обычно считается, что они принадлежат к линии Caenophidia (таксон, содержащий все ядовитые змеи), хотя по крайней мере один предполагаемый гомолог 3FTx был идентифицирован в геноме бирманского питона , члена сестринского таксона . Ранняя работа по анализу гомологии белков путем выравнивания последовательностей в 1970-х годах показала, что белки 3FTx, возможно, произошли от предковой рибонуклеазы ; однако более поздние исследования молекулярной филогении показывают, что белки 3FTx произошли от нетоксичных белков с тремя пальцами.
Среди ядовитых змей распределение белков 3FTx варьирует; они особенно обогащены ядом семейства Elapidae . У королевской кобры ( Ophiophagus hannah ) и восточной зеленой мамбы ( Dendroaspis angusticeps ) белки 3FTx составляют около 70% белковых токсинов в яде; среди пустынных коралловых змей ( Micrurus tschudii ) эта доля достигает 95%.
Считается, что гены, кодирующие трехпальцевые токсины, эволюционировали в результате дупликации генов . Традиционно это концептуализировалось как повторяющиеся события дупликации, за которыми следует неофункционализация и рекрутирование в паттерны экспрессии генов , ограниченные ядовитыми железами. Однако утверждалось, что этот процесс должен происходить крайне редко и что субфункционализация лучше объясняет наблюдаемое распределение. Совсем недавно было обнаружено, что нетоксичные белки 3FP широко экспрессируются во многих различных тканях у змей, что подтолкнуло к альтернативной гипотезе о том, что белки с ограниченной экспрессией в слюне избирательно задействованы для токсической функциональности. Есть свидетельства того, что большинство типов белков 3FTx подвергались положительному отбору (то есть диверсифицирующему отбору) в своей недавней эволюционной истории, возможно, из-за эволюционной гонки вооружений с видами-жертвами. Заметными исключениями являются димерное семейство каппа-бунгаротоксина , вероятно, в результате эволюционных ограничений на интерфейс димеров, и семейство кардиотоксин / цитотоксин, в котором большая часть остатков белка, как полагают, играет функциональную роль.