Тимоцит - Thymocyte
Тимоцитов является иммунная клетка присутствует в тимусе , прежде чем он претерпевает превращение в Т - клетки . Тимоциты образуются в костном мозге в виде стволовых клеток и достигают вилочковой железы через кровь . Тимопоэз описывает процесс, который превращает тимоциты в зрелые Т-клетки в соответствии с отрицательным или положительным отбором. Этот процесс отбора жизненно важен для преобразования популяции тимоцитов в периферический пул Т-клеток, которые способны реагировать на чужеродные патогены, но остаются толерантными к собственным антигенам организма. Положительный отбор отбирает клетки, которые способны связывать молекулы MHC класса I или II, по крайней мере, со слабым сродством. Это устраняет (с помощью процесса, называемого «смерть из-за пренебрежения») те Т-клетки, которые были бы нефункциональными из-за неспособности связывать MHC. Отрицательный отбор разрушает тимоциты с высоким сродством к собственным пептидам или MHC. Это устраняет клетки, которые будут направлять иммунные ответы на собственные белки на периферии. Отрицательный отбор не эффективен на 100%, и некоторые аутореактивные Т-клетки ускользают и попадают в кровоток. Существуют дополнительные механизмы периферической толерантности, чтобы заставить эти клетки замолчать, но если они не работают, может возникнуть аутоиммунитет .
Этапы созревания
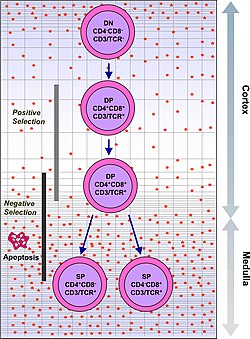
Тимоциты подразделяются на несколько отдельных стадий созревания на основе экспрессии маркеров клеточной поверхности. Самая ранняя стадия тимоцитов - это двойная отрицательная стадия (отрицательная как для CD4, так и для CD8), которая в последнее время была лучше описана как Lineage-negative и которую можно разделить на четыре подстадии. Следующая важная стадия - это двойная положительная стадия (положительная как для CD4, так и для CD8). Заключительная стадия созревания - это единственная положительная стадия (положительная либо на CD4, либо на CD8).
У мышей
| Этап | Определение маркеров поверхности | Место нахождения | Значимые события |
| Двойной отрицательный 1 или ETP (предшественник ранней линии T) | Происхождение- CD44 + CD25 - CD117 + | кора | Пролиферация, потеря B и миелоидного потенциала |
| Двойной отрицательный 2 | Линия-CD44 + CD25 + CD117 + | кора | - |
| Двойной отрицательный 3 | Lineage-CD44-CD25 + | кора | Перегруппировка TCR-бета, бета-отбор |
| Двойной отрицательный 4 | Линия-CD44-CD25- | кора | - |
| Двойной положительный | CD4 + CD8 + | кора | Перегруппировка TCR-альфа, положительный отбор, отрицательный отбор |
| Одиночный положительный | CD4 + CD8- или CD4-CD8 + | мозговое вещество | Отрицательный выбор |
В людях
У людей циркулирующие CD34 + гемопоэтические стволовые клетки ( HSC ) находятся в костном мозге. Они продуцируют предшественников Т-лимфоцитов, которые засевают тимус (становясь тимоцитами) и дифференцируются под влиянием Notch и его лигандов.
Ранние, дважды отрицательные тимоциты экспрессируют (и могут быть идентифицированы) CD2 , CD5 и CD7 . Тем не менее во время двойной отрицательной стадии экспрессия CD34 прекращается и экспрессируется CD1 . Экспрессия как CD4, так и CD8 делает их дважды положительными и превращается в клетки CD4 + или CD8 +.
События во время созревания
| тип: | функциональный (бета-выбор) | функциональный (положительный выбор) | автореактивный (отрицательный выбор) |
| место нахождения: | кора | кора | кора / мозговой слой |
 |
Чтобы пройти контрольную точку β-отбора, β-цепь рецептора Т-клетки, перестроенная тимоцитом, должна сохранять структурные свойства, позволяющие ей быть представлены на поверхности тимоцита с пре-TCRα. Это устраняет тимоциты с грубыми дефектами, введенными в рецептор Т-клеток путем перестройки генов. |
Чтобы быть положительно отобранными , тимоциты должны будут взаимодействовать с несколькими молекулами клеточной поверхности, MHC , чтобы гарантировать реактивность и специфичность. Положительный отбор отбирает клетки с Т-клеточным рецептором, способным связывать молекулы MHC класса I или II, по крайней мере, со слабым сродством. Это устраняет (с помощью процесса, называемого «смерть из-за пренебрежения») те Т-клетки, которые были бы нефункциональными из-за неспособности связывать MHC. |
Отрицательный отбор - это активная индукция апоптоза в тимоцитах с высоким сродством к собственным пептидам или MHC. Это устраняет клетки, которые будут направлять иммунные ответы на собственные белки на периферии. Отрицательный отбор не эффективен на 100%, некоторые аутореактивные Т-клетки избегают цензуры тимуса и попадают в кровоток. Существуют дополнительные механизмы толерантности, активные на периферии, чтобы заставить эти клетки замолчать, такие как анергия , делеция и регуляторные Т-клетки . Если эти периферические механизмы толерантности также не работают, может возникнуть аутоиммунитет . |
Заселение вилочковой железы
В конечном итоге тимоциты происходят из гемопоэтических клеток-предшественников костного мозга [см. Гемопоэтические стволовые клетки , гемопоэз ], которые достигают тимуса через кровообращение. Считается, что количество предшественников, попадающих в тимус каждый день, чрезвычайно мало. Поэтому неизвестно, какие предшественники колонизируют вилочковую железу. В настоящее время предполагается, что ранние лимфоидные предшественники (ELP) заселяют тимус и, вероятно, являются предшественниками по крайней мере некоторых тимоцитов. ELP относятся к Lineage-CD44 + CD25-CD117 + и, таким образом, очень похожи на ETP, самых ранних предшественников в тимусе. Предшественники попадают в тимус через кортико-мозговое соединение. Молекулы, которые, как известно, важны для проникновения в тимус, включают Р-селектин (CD62P) и хемокиновые рецепторы CCR7 и CCR9 .
После проникновения в тимус предшественники размножаются с образованием популяции ETP. За этим этапом следует образование тимоцитов DN2, которые мигрируют от кортико-мозгового соединения к капсуле вилочковой железы. Тимоциты DN3 образуются в субкапсулярной зоне.
Помимо пролиферации, в популяции тимоцитов DN происходит дифференцировка и предопределение T-линии. Приверженность или потеря альтернативных клональных потенциалов (таких как миелоидные, B- и NK-клональные потенциалы) зависит от передачи сигналов Notch и завершается на стадии DN3. После связывания Т-линии тимоциты DN3 подвергаются β-селекции.
β-отбор
Способность Т-клеток распознавать чужеродные антигены опосредуется рецептором Т-клеток (TCR), который представляет собой поверхностный белок, способный распознавать короткие белковые последовательности ( пептиды ), представленные на MHC . Целью развития тимоцитов является производство зрелых Т-клеток с разнообразным набором функциональных Т-клеточных рецепторов посредством процесса перестройки гена TCR.
В отличие от большинства генов, которые имеют стабильную последовательность в каждой экспрессирующей их клетке, рецептор Т-клеток состоит из ряда альтернативных фрагментов генов. Чтобы создать функциональный Т-клеточный рецептор, двойные отрицательные тимоциты используют ряд ДНК-взаимодействующих ферментов, чтобы обрезать ДНК и объединить отдельные фрагменты генов. Результатом этого процесса является то, что каждый рецептор Т-клеток имеет различную последовательность из-за разного выбора фрагментов генов и ошибок, вносимых во время процесса разрезания и соединения ( дополнительную информацию о реаранжировке TCR см. В разделе о рекомбинации V (D) J ). . Эволюционное преимущество наличия большого количества уникальных рецепторов Т-клеток заключается в том, что каждая Т-клетка способна распознавать разные пептиды, обеспечивая защиту от быстро развивающихся патогенов.
Перестройка TCR происходит в два этапа. Сначала происходит перестройка цепи TCRβ на стадии DN3 развития Т-клеток. Цепь TCRβ спаривается с пре-Tα для образования пре-TCR. Клеточным недостатком процесса реаранжировки является то, что многие комбинации фрагментов гена рецептора Т-клетки нефункциональны. Чтобы устранить тимоциты, которые создали нефункциональный Т-клеточный рецептор , только клетки, которые успешно перестроили бета-цепь, чтобы произвести функциональный пре-TCR, могут развиваться за пределами стадии DN3. Клетки, которые не могут продуцировать функциональный пре-TCR, уничтожаются апоптозом . Этот процесс называется контрольной точкой бета-выбора. Для успешной бета-селекции необходимо, чтобы продуцировался TCRβ, TCRβ был способен спариваться с пре-Tα для генерации пре-TCR и чтобы пре-TCR мог взаимодействовать на поверхности клетки с сигнальными белками TCR.
На стадии β-отбора, подобно зрелому TCR, пре-TCR также формирует иммунологический синапс. Хотя взаимодействие пре-TCR и связанного с пептидом MHC не является существенным для развития Т-клеток, оно играет решающую роль в стимулировании преимущественной пролиферации клеток, пре-TCR которых может связывать собственный MHC.
После β-отбора тимоциты генерируют CD4 + CD8 + двойные положительные клетки, которые затем подвергаются перестройке TCRα, что приводит к полностью собранному TCR.
Положительный отбор и приверженность к родословной
Тимоциты, прошедшие β-селекцию, экспрессируют Т-клеточный рецептор, способный собираться на поверхности. Однако многие из этих Т-клеточных рецепторов по- прежнему будут нефункциональными из-за неспособности связывать MHC . Следующим важным этапом развития тимоцитов является положительный отбор, чтобы сохранить только те тимоциты, которые имеют рецептор Т-клеток, способный связывать MHC. Рецептору Т-клеток требуется CD8 в качестве корецептора для связывания с MHC класса I и CD4 в качестве корецептора для связывания MHC класса II. На этой стадии тимоциты активируют как CD4, так и CD8 , становясь дважды положительными клетками.
Двойные положительные тимоциты, которые имеют Т-клеточный рецептор, способный связывать МНС класса I или класса II (даже со слабым сродством), получают сигнал через Т-клеточный рецептор. Тимоциты, у которых есть рецептор Т-клеток, неспособный связывать MHC класса I или класса II, подвергаются апоптозу . Некоторые тимоциты способны спасти неудачный положительный отбор путем редактирования рецептора (перестройка аллеля другого Т-клеточного рецептора с образованием нового Т-клеточного рецептора).
Двойные положительные тимоциты подвергаются клонированию, созревая в CD8 + Т-клетку (распознающую MHC класса I) или CD4 + T-клетку (распознающую MHC класса II). Компетенция клонов происходит на поздней стадии положительного отбора и работает путем подавления как CD4, так и CD8 (уменьшение сигнала от рецептора Т-клеток), а затем только активации CD4. Тимоциты, которые снова начинают получать сигнал, - это те, которые распознают MHC класса II, и они становятся CD4 + Т-клетками. Тимоциты, которые не начинают снова получать сигнал, - это те, которые распознают MHC класса I, и они подавляют CD4 и повышают активность CD8, превращаясь в CD8 + Т-клетки. Оба этих типа тимоцитов известны как одиночные положительные тимоциты.
Отрицательный выбор
Успех положительного отбора позволяет тимоциту претерпевать ряд изменений созревания во время перехода к одной положительной Т-клетке. Единичные положительные Т-клетки активируют хемокиновый рецептор CCR7, вызывая миграцию из коры головного мозга в мозговой слой. На этом этапе ключевой процесс созревания включает отрицательный отбор, устранение аутореактивных тимоцитов.
Ключевым недостатком процесса перестройки генов для Т-клеточных рецепторов является то, что по случайной случайности некоторые компоновки генных фрагментов будут создавать Т-клеточный рецептор, способный связывать собственные пептиды, представленные на MHC класса I или MHC класса II. Если Т-клетки, несущие эти Т-клеточные рецепторы, проникнут на периферию, они будут способны активировать иммунный ответ против себя, что приведет к аутоиммунитету . Отрицательный отбор - это процесс, разработанный для снижения этого риска. Во время отрицательной селекции все тимоциты с высоким сродством к связыванию собственных пептидов, представленных на MHC класса I или класса II, индуцируются для активации BCL2L11 , белка, который управляет апоптозом. Клетки, не обладающие высоким сродством к аутоантигенам, выживают при отрицательном отборе. На этой стадии также отбирают некоторые клетки, которые становятся регуляторными Т-клетками , обычно это клетки, которые обладают промежуточным сродством к собственному пептиду.
Отрицательный отбор может происходить на стадии двойного положительного в коре головного мозга. Однако репертуар пептидов в коре ограничен пептидами, экспрессируемыми эпителиальными клетками, и дважды положительные клетки плохо переносят отрицательный отбор. Следовательно, когда клетки находятся на единственной положительной стадии, наиболее важным участком отрицательной селекции является мозговое вещество. Чтобы удалить тимоциты, реагирующие на периферические органы, факторы транскрипции Aire и Fezf2 управляют экспрессией множества периферических антигенов, таких как инсулин, что приводит к удалению клеток, специфичных для этих антигенов. Это позволяет единичным положительным тимоцитам подвергаться воздействию более сложного набора аутоантигенов, чем присутствует в коре головного мозга, и, следовательно, более эффективно удаляет те Т-клетки, которые являются аутореактивными.
Единичные положительные тимоциты остаются в мозговом веществе в течение 1-2 недель, исследуя аутоантигены для проверки на аутореактивность. За это время они претерпевают окончательные изменения созревания, а затем выходят из тимуса с помощью S1P и CCR7. Попадая в периферический кровоток , клетки считаются зрелыми Т-клетками, а не тимоцитами.
Отрицательный отбор не эффективен на 100%, некоторые аутореактивные Т-клетки избегают цензуры тимуса и попадают в кровоток. Существуют дополнительные механизмы периферической толерантности, активные на периферии, чтобы заставить эти клетки замолчать, такие как анергия , делеция и регуляторные Т-клетки . Если эти периферические механизмы толерантности также не работают, может возникнуть аутоиммунитет .
Трансплантация тимуса приводит к тому, что Т-клетки учатся вместо этого избегать реакции с донорскими антигенами и могут по-прежнему реагировать со многими аутоантигенами в организме. Аутоиммунное заболевание - частое осложнение после трансплантации тимуса, обнаруживаемое у 42% пациентов в течение 1 года после трансплантации. Однако отчасти это объясняется тем, что само указание, то есть полный синдром ДиДжорджи (отсутствие тимуса), увеличивает риск аутоиммунного заболевания.
Рак
Тимоциты, которые приобретают онкогенные мутации, допускающие неконтролируемую пролиферацию, могут стать лимфомами тимуса .
Альтернативные родословные
Помимо классических αβ Т-клеток (их развитие описано выше), в тимусе развивается ряд других Т-клонов, включая γδ Т-клетки и Т-клетки естественных киллеров (NKT). Кроме того, в тимусе могут развиваться другие не Т-гемопоэтические клоны, включая В-лимфоциты (В-клетки), лимфоциты-киллеры (NK-клетки), миелоидные клетки и дендритные клетки. Однако вилочковая железа не является источником B, NKC или миелоидного развития (это утверждение не верно для всех B-клеток или NKC). Развитие этих клеток в тимусе отражает многопотенциальную природу гематопоэтических предшественников, которые засевают тимус. Зрелые B-клетки и другие APC также могут быть обнаружены в мозговом веществе, что способствует процессам отрицательного отбора.