Нитрат свинца (II) - Lead(II) nitrate
|
|
|||
| Характеристики | |||
|---|---|---|---|
| Pb (NO 3 ) 2 | |||
| Молярная масса | 331,2 г / моль | ||
| Появление | бесцветный или белый | ||
| Плотность | 4,53 г / см 3 | ||
| Температура плавления | разлагается | ||
| 376,5 г / л (0 ° C) 597 г / л (25 ° C) 1270 г / л (100 ° C) |
|||
| Опасности | |||
| Паспорт безопасности | ICSC 1000 | ||
|
Классификация ЕС (DSD) (устарела)
|
Repr. Кошка. 1/3 Токсично ( T ) Вредно ( Xn ) Опасно для окружающей среды ( N ) |
||
| NFPA 704 (огненный алмаз) | |||
| Смертельная доза или концентрация (LD, LC): | |||
|
LD Lo ( самый низкий опубликованный )
|
500 мг / кг (морская свинка, перорально) | ||
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|||
| Ссылки на инфобоксы | |||
Нитрат свинца (II) представляет собой неорганическое соединение с химической формулой Pb ( NO 3 ) 2 . Обычно он представляет собой бесцветный кристалл или белый порошок и, в отличие от большинства других солей свинца (II) , растворим в воде .
Известный со времен средневековья под названием plumbum dulce , производство нитрата свинца (II) из металлического свинца или оксида свинца в азотной кислоте было мелкомасштабным, для непосредственного использования в производстве других соединений свинца . В девятнадцатом веке нитрат свинца (II) начал коммерчески производиться в Европе и Соединенных Штатах. Исторически сложилось так, что основное использование было в качестве сырья при производстве пигментов для свинцовых красок , но такие краски были заменены менее токсичными красками на основе диоксида титана . Другие промышленные применения включали тепла стабилизации в нейлон и полиэфиров , а также в покрытиях photothermographic бумаги. Примерно с 2000 года нитрат свинца (II) начал использоваться для цианирования золота .
Нитрат свинца (II) токсичен, и с ним необходимо обращаться осторожно, чтобы предотвратить его вдыхание, проглатывание и контакт с кожей. Из-за своей опасной природы ограниченное применение нитрата свинца (II) находится под постоянным контролем.
История
Нитрат свинца был впервые обнаружен в 1597 году алхимиком Андреасом Либавиусом , который назвал это вещество plumbum dulce , что означает «сладкий свинец», из-за его вкуса. Его производят в промышленных масштабах путем реакции металлического свинца с концентрированной азотной кислотой, в которой он плохо растворяется. Он был произведен в качестве сырья для изготовления таких пигментов, как хромовый желтый (хромат свинца (II), PbCrO 4 ) и хромовый оранжевый (основной хромат свинца (II), Pb 2 CrO 5 ) и неаполитанский желтый . Эти пигменты использовались для окрашивания и печати ситца и других тканей. Он использовался как окислитель в дымном порохе и вместе с азидом свинца в специальных взрывчатых веществах .
Производство
Нитрат свинца получают реакцией оксида свинца (II) с концентрированной азотной кислотой:
- PbO + 2 HNO 3 (концентрированный) → Pb (NO 3 ) 2 ↓ + H 2 O
Также может быть получено испарение раствора, полученного реакцией металлического свинца с разбавленной азотной кислотой .
- Pb + 4 HNO 3 → Pb (NO 3 ) 2 + 2 NO 2 + 2 H 2 O
Растворы и кристаллы нитрата свинца (II) образуются при переработке свинцово- висмутовых отходов свинцовых заводов.
Состав
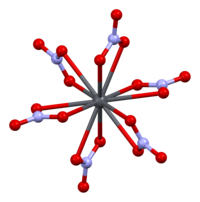
Кристаллическая структура твердого нитрата свинца (II) была определена с помощью дифракции нейтронов . Соединение кристаллизуется в кубической системе с атомами свинца в гранецентрированной кубической системе. Его пространственная группа Pa3 Z = 4 ( обозначение решетки Браве ), каждая сторона куба имеет длину 784 пикометра .
Черные точки представляют атомы свинца, белые точки - нитратные группы на 27 пикометров выше плоскости атомов свинца, а синие точки - нитратные группы на том же расстоянии ниже этой плоскости. В этой конфигурации каждый атом свинца связан с двенадцатью атомами кислорода ( длина связи : 281 пм). Все длины связей N – O идентичны и составляют 127 пикометров.
Исследовательский интерес к кристаллической структуре нитрата свинца (II) частично был основан на возможности свободного внутреннего вращения нитратных групп внутри кристаллической решетки при повышенных температурах, но этого не произошло.
Химические свойства и реакции
Нитрат свинца разлагается при нагревании - свойство, используемое в пиротехнике . Он растворим в воде и разбавленной азотной кислоте.
Основные нитраты образуются при добавлении щелочи в раствор. Pb 2 (OH) 2 (NO 3 ) 2 является преобладающим веществом, образующимся при низких значениях pH. При более высоком pH образуется Pb 6 (OH) 5 (NO 3 ). Катион [Pb 6 O (OH) 6 ] 4+ необычен тем, что он имеет оксидный ион внутри кластера из 3 тетраэдров PbO 4 с общими гранями. Нет никаких доказательств образования гидроксида Pb (OH) 2 в водном растворе с pH ниже 12.
Растворы нитрата свинца можно использовать для образования координационных комплексов. Свинец (II) - жесткий акцептор ; он образует более прочные комплексы с электронодонорными лигандами азота и кислорода . Например, объединение нитрата свинца и пентаэтиленгликоля (EO 5 ) в растворе ацетонитрила и метанола с последующим медленным испарением дает соединение [Pb (NO 3 ) 2 (EO 5 )]. В кристаллической структуре этого соединения цепь EO 5 обернута вокруг иона свинца в экваториальной плоскости, аналогичной краун-эфиру . Два бидентатных нитратных лиганда находятся в транс-конфигурации . Общее координационное число равно 10, с ведущим ионом в bicapped площади антипризмы молекулярной геометрии .
Комплекс, образованный нитратом свинца с бидентатным N-донорным лигандом битиазола, является биядерным. Кристаллическая структура показывает, что нитратная группа образует мостик между двумя атомами свинца. Один интересный аспект комплексов этого типа - наличие физического зазора в координационной сфере ; т.е. лиганды не расположены симметрично вокруг иона металла. Это потенциально связано с неподеленной парой электронов свинца, которая также обнаруживается в комплексах свинца с имидазольным лигандом.
Приложения
Нитрат свинца использовался в качестве термостабилизатора в нейлоне и полиэфирах, в качестве покрытия для фототермографической бумаги и в родентицидах .
Нагревание нитрата свинца - удобный способ получения диоксида азота.
- 2 Pb (NO 3 ) 2 → 2 PbO + 4 NO 2 + O 2
В процессе цианирования золота добавление раствора нитрата свинца (II) улучшает процесс выщелачивания . Требуются только ограниченные количества (от 10 до 100 миллиграммов нитрата свинца на килограмм золота).
В органической химии его можно использовать для получения изотиоцианатов из дитиокарбаматов . Сообщалось о его использовании в качестве поглотителя бромида во время замещения S N 1 .
Безопасность
Нитрат свинца (II) токсичен, и проглатывание может привести к острому отравлению свинцом, как и все растворимые соединения свинца. Все неорганические соединения свинца классифицируются Международным агентством по изучению рака (IARC) как вероятно канцерогенные для человека (Категория 2A). Они были связаны с раком почек и глиомой у экспериментальных животных и с раком почек, раком мозга и раком легких у людей, хотя исследования рабочих, подвергшихся воздействию свинца, часто осложняются одновременным воздействием мышьяка . Свинец , как известен, заменитель цинка в ряде ферментов , в том числе дегидратаза б-аминолевулиновой кислоты (порфобилиноген - синтазы) в геме пути биосинтеза и пиримидин-5'-нуклеотидаза , важный для правильного метаболизма ДНК и , следовательно , может привести к плоду вреда.
использованная литература
внешние ссылки
- Вудбери, Уильям Д. (1982). «Свинец» . Минеральный Ежегодник Металлы и минералы . Бюро шахт : 515-42 . Проверено 18 января 2008 .
- «Свинец» . Карманный справочник NIOSH по химической опасности . Национальный институт охраны труда и здоровья. Сентябрь 2005 г. NIOSH 2005-149 . Проверено 19 января 2008 .
- «Свинец и свинцовые соединения» . Национальный кадастр загрязнителей . Правительство Австралии, Департамент окружающей среды и водных ресурсов. Июль 2007. Архивировано из оригинального 11 - го января 2008 года . Проверено 19 января 2008 .
- «Свинец» . Здоровая домашняя среда, опасность для здоровья . Альянс США за здоровый дом. Архивировано из оригинала на 2008-02-20 . Проверено 19 января 2008 .
- Паспорта безопасности
- MSDS для нитрата свинца, PTCL, Оксфордский университет
- Паспорт безопасности материалов для нитрата свинца, Science Stuff Inc
- Паспорт безопасности материалов для нитрата свинца, Университет штата Айова