Пропионил-КоА карбоксилаза - Propionyl-CoA carboxylase
| Пропионил-КоА карбоксилаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Гетеро12мер пропионил-КоА-карбоксилазы, Methylorubrum extorquens
| |||||||||
| Идентификаторы | |||||||||
| ЕС нет. | 6.4.1.3 | ||||||||
| № CAS | 9023-94-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | Amigo / QuickGO | ||||||||
| |||||||||
| Метилмалонил-КоА декарбоксилаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| ЕС нет. | 4.1.1.41 | ||||||||
| № CAS | 37289-44-4 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | Amigo / QuickGO | ||||||||
| |||||||||
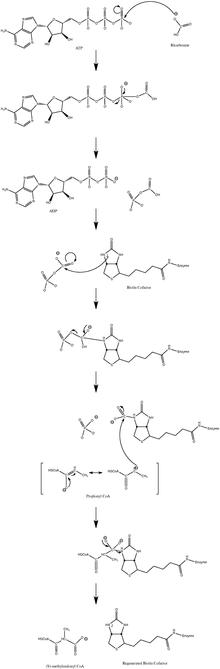
Пропионил-КоА карбоксилаза ( PCC ) катализирует реакцию карбоксилирования пропионил-КоА в митохондриальном матриксе . Фермент биотин- зависимый. Продукт реакции - (S) - метилмалонил-КоА . Пропионил-КоА является конечным продуктом метаболизма жирных кислот с нечетной цепью, а также является метаболитом большинства жирных кислот с метил-разветвленной цепью . Он также является основным метаболитом валина и вместе с ацетил-КоА является метаболитом изолейцина, а также метаболитом метионина . Таким образом, пропионил-КоА имеет большое значение как предшественник глюкозы . (S) -метилмалонил-КоА не может напрямую использоваться животными; на него действует рацемаза с образованием (R) -метилмалонил-КоА. Последний преобразуется мутазой метилмалонил-КоА (один из очень немногих ферментов, зависящих от витамина В 12 ) в сукцинил-КоА . Последний превращается в оксалоацетат, а затем в малат в цикле Кребса . Экспорт малата в цитозоль приводит к образованию оксалоацетата , фосфоенолпирувата и других глюконеогенных промежуточных продуктов.
- АТФ + пропионил-КоА + HCO 3 - <=> АДФ + фосфат + (S) -метилмалонил-КоА
Он был классифицирован как лигаза и лиаза .
Структура фермента
Пропионил-КоА-карбоксилаза (PCC) представляет собой альфа (6) -бета (6) -додекамер 750 кДа. (Только приблизительно 540 кДа является природным ферментом.) Альфа-субъединицы расположены как мономеры, украшающие центральное гексамерное ядро бета-6. Этот сердечник ориентирован в виде короткого цилиндра с отверстием вдоль его оси.
Альфа-субъединица PCC содержит домены биотинкарбоксилазы (BC) и белка-носителя биотина карбоксила (BCCP). Домен, известный как домен BT, также расположен на альфа-субъединице и необходим для взаимодействия с бета-субъединицей. Особенно интересна восьмицепочечная антипараллельная бета-бочкообразная складка этого домена. Бета-субъединица содержит активность карбоксилтрансферазы (СТ).

Сайты BC и КТ приблизительно 55 Å друг от друга, что свидетельствует о всей области BCCP транслокации в ходе катализа карбоксилирования из пропионила-КоА . Это обеспечивает четкое свидетельство решающего димерного взаимодействия между альфа- и бета-субъединицами.
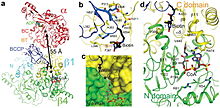
Биотин-связывающий карман PCC является гидрофобным и высококонсервативным. Биотин и пропионил-КоА связываются перпендикулярно друг другу в активном центре, содержащем оксианионную дырку . Отношение нативного фермента к биотину составляет один моль нативного фермента на 4 моля биотина. Считается, что N1 биотина является основанием активного сайта.
Сайт-направленный мутагенез в D422 показывает изменение субстратной специфичности сайта связывания пропионил-CoA, что указывает на важность этого остатка в каталитической активности PCC. В 1979 году ингибирование фенилглиоксалем определило, что фосфатная группа из пропионил-КоА или АТФ реагирует с существенным остатком аргинина в активном центре во время катализа. Позже (2004) было высказано предположение, что аргинин-338 служит для ориентации карбоксифосфатного интермедиата для оптимального карбоксилирования биотина.
Значения КМ для АТФ, пропионил-КоА и бикарбоната составляют 0,08 мМ, 0,29 мМ и 3,0 мМ соответственно. Изоэлектрической точкой падает при рН 5,5. Структурная целостность PCC сохраняется в диапазоне температур от -50 до 37 градусов Цельсия и диапазоне pH от 6,2 до 8,8. Было показано, что оптимальный pH составляет от 7,2 до 8,8 без связывания биотина. Для биотина оптимальный pH составляет 8,0-8,5.
Ферментный механизм
Обычный механизм каталитической реакции включает промежуточный карбанион и не протекает через согласованный процесс. На рисунке 3 показан вероятный путь.
Было показано, что реакция слегка обратима при низком потоке пропионил-КоА.
Изоферменты
Люди экспрессируют следующие два изофермента пропионил-КоА-карбоксилазы :
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Патология
Дефицит связан с пропионовой ацидемией .
Активность PCC является наиболее чувствительным индикатором статуса биотина на сегодняшний день. В будущих исследованиях беременности использование данных об активности ПКС лимфоцитов должно оказаться полезным для оценки биотинового статуса.
Внутригенная комплементация
Когда несколько копий полипептида, кодируемого геном, образуют агрегат, эта структура белка называется мультимером. Когда мультимер формируется из полипептидов, продуцируемых двумя разными мутантными аллелями конкретного гена, смешанный мультимер может проявлять большую функциональную активность, чем несмешанные мультимеры, образованные каждым из мутантов по отдельности. В таком случае явление называется внутригенной комплементацией .
PCC представляет собой гетерополимер, состоящий из субъединиц α и β в структуре α 6 β 6 . Мутации в PCC, либо в субъединице α (PCCα), либо в субъединице β (PCCβ), могут вызывать пропионовую ацидемию у людей. Когда разные мутантные клеточные линии фибробластов кожи, дефектные по PCCβ, были слиты в попарных комбинациях, образующийся в результате β- гетеромультимерный белок часто проявлял более высокий уровень активности, чем можно было бы ожидать, исходя из активности родительских ферментов. Это открытие внутригенной комплементации показало, что мультимерная структура PCC допускает кооперативные взаимодействия между составляющими мономерами PCCβ, которые могут генерировать более функциональную форму холофермента.
Регулирование
Пропионил-КоА карбоксилазы
а. Карбамазепин (противоэпилептический препарат): значительно снижает уровень ферментов в печени.
б. E.coli , шаперонина белки GroES и GroEL: существенный для складывания и сборок человеческого PCC гетеромерных субъединиц
c. Бикарбонат: отрицательная кооперативность
d. Mg 2+ и MgATP 2- : аллостерическая активация
Пропионил-КоА-карбоксилазой
а. 6-дезоксиэритронолид B: снижение уровня PCC приводит к увеличению производства
б. Глюкокиназа в бета-клетках поджелудочной железы: предшественник бета-PCC, как показано, снижает KM и увеличивает Vmax; активация
Смотрите также
использованная литература
внешние ссылки
- Пропионил-КоА + карбоксилаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)