Селективный модулятор рецепторов прогестерона - Selective progesterone receptor modulator
| Селективный модулятор рецепторов прогестерона | |
|---|---|
| Класс препарата | |

Улипристала ацетат , SPRM, который используется в качестве средства экстренной контрацепции и при лечении миомы матки .
| |
| Идентификаторы класса | |
| Синонимы | SPRM |
| Использовать | Экстренная контрацепция , миома матки |
| Код УВД | G03XB |
| Биологическая мишень | Рецептор прогестерона |
| Химический класс | Стероидный |
| В Викиданных | |
Модулятор рецептора селективный прогестерона ( SPRM ) представляет собой агент , который действует на рецептор прогестерона (PR), в биологической мишени из гестагенов , как прогестерон . Характеристика, которая отличает такие вещества от полных агонистов рецепторов (например, прогестерона, прогестинов ) и полных антагонистов (например, аглепристона ), заключается в том, что их действие отличается в разных тканях , т.е. агонисты в одних тканях и антагонисты в других. Этот смешанный профиль действия приводит к стимуляции или ингибированию тканеспецифичным образом, что дополнительно увеличивает возможность отделения нежелательных побочных эффектов от разработки кандидатов в синтетические PR-модуляторы .
История
С момента открытия гормона прогестерона в середине 1930-х годов. и особенно после открытия его рецептора в 1970 году возник значительный интерес к разработке антагонистического агента для терапевтического использования. Были синтезированы различные аналоги прогестерона , известные как прогестины , и в 1981 году был представлен первый антагонист рецепторов прогестерона под названием RU 38486 (RU 486, мифепристон ). Однако клиническое ограничение мифепристона из-за его относительно высокой аффинности связывания с рецептором глюкокортикоидов по сравнению с рецептором прогестерона вызвало потребность в более селективных антагонистах прогестерона для минимизации риска побочных эффектов. В качестве вклада были разработаны так называемые селективные модуляторы рецепторов прогестерона (SPRM). Они были описаны как агенты со смешанным антагонистическим и агонистическим действием на рецепторы прогестерона тканеспецифичным образом, при минимальном взаимодействии с другими стероидными рецепторами . В отличие от антагонистов прогестерона, смешанные агонисты-антагонисты SPRM из-за присущей им агонистической активности прогестерона практически не влияют на прерывание беременности и поэтому идеально подходят для лечения гинекологических состояний без исключения возможности беременности. Были описаны как стероидные, так и нестероидные SPRM, и наиболее яркими примерами являются асоприснил , который не прошел клинические испытания фазы 3 в 2008 г., и улипристала ацетат , первый SPRM на рынке (2009 г. в Европе).
Рецептор прогестерона
Рецептор
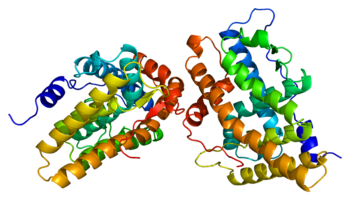
В качестве белка , то рецептор прогестерона (рис. 1) является членом лиганд-зависимого рецептора гормона ядерного семейства. Были идентифицированы две основные изоформы рецепторов прогестерона , A и B, а также некоторые другие менее распространенные варианты сплайсинга , и все они кодируются одним и тем же геном из 8 экзонов . Как и другие стероидные ядерные рецепторы , полноразмерный белок, изоформа B, можно разделить на 4 функциональные области, а именно вариабельную N-концевую область, за которой следует высококонсервативный ДНК-связывающий домен , вариабельная шарнирная область и умеренно консервативный лиганд-связывающий домен. Сайт связывания лиганда, известный как домен AF2 , экспрессируется экзонами 4-8, соответствующими 253 аминокислотам , и его структура представляет большой интерес для разработки SPRM. Он состоит из 10 α-спиралей (H1, H3-H12), образующих 3-х слойный пучок, обвитых 4 β-листами . H12 представляет собой конденсированную непрерывную единицу, состоящую из спиралей 10 и 11, которые, как предполагается, участвуют в процессе связывания соактиватора . Лиганд-связывающий домен рецептора находится в равновесии между двумя различными конформациями. Первая - это конформация агониста, которая способствует связыванию белков- коактиваторов, что, в свою очередь, способствует усилению транскрипции генов. Вторая - антагонистическая конформация, которая, напротив, способствует связыванию корепрессоров и, как следствие, подавлению экспрессии генов. Полные агонисты, такие как прогестерон, которые проявляют агонистические свойства во всех тканях, сильно сдвигают конформационное равновесие в сторону агонистов. Напротив, полные антагонисты, такие как аглепристон, сильно сдвигают равновесие в сторону антагонистов. Наконец, общее соотношение концентраций соактиватора и корепрессора может различаться в разных типах клеток.
Рецептор, связанный с G-белком
На рубеже тысячелетий стало очевидно, что активность прогестерона опосредуется не только через фактор транскрипции, но также через мембраносвязанный рецептор, связанный с G-белком, обозначенный как 7TMPR . Когда рецептор активируется, он блокирует аденилатциклазу , что приводит к снижению биосинтеза внутриклеточного вторичного мессенджера цАМФ .
Последующие механизмы
С 1990-х годов стало очевидно, что два основных изомера рецепторов, A и B, функционально различны в женской репродуктивной системе . Исследования, нацеленные на профиль экспрессии изомеров, предполагают, что изомеры экспрессируются в разных тканях в разное время на протяжении менструального цикла . Было обнаружено, что PR-B активируется в строме и железистом эпителии во время фолликулярной фазы , но снижается в обеих тканях во время лютеиновой фазы . Напротив, PR-A активируется в обоих типах тканей в фолликулярной фазе и сохраняется в стромальной ткани во время поздней лютеиновой фазы. Исследования показали, что активация PR-B важна для роста и развития молочной железы , тогда как PR-A играет важную роль в нормальной репродуктивной функции и овуляции . Кроме того, исследования in vitro показали, что в идентичных условиях PR-B работает как более сильный трансактиватор репортерных генов , в то время как PR-A способен трансрепрессировать PR-B и другие стероидные рецепторы. Были найдены различные причины такого разнообразия функций между изоформами. Прежде всего следует упомянуть, что изоформа A рецептора прогестерона не имеет 164 N-концевых аминокислот по сравнению с изомером B, что лишает его функции активации AF-3 из-за потери B-вышестоящего сегмента, что оставляет ему только 2 функции активации. Кроме того, исследования механизма показали различие в привлечении кофакторов между изоформами. Из-за этих функциональных различий можно понять, почему существует интерес к разработке лекарства, которое может избирательно нацеливаться на изоформы рецептора. В некоторых случаях разработка SPRM была сосредоточена на нацеливании на эти две разные изоформы.
Взаимодействие SPRM с карманами связывания рецепторов
Было описано, что определенные взаимодействия между лигандом и рецептором прогестерона важны для связывания лиганда (рис. 2). Кристаллографические исследования прогестерона, связанного с его рецептором, выявили важное взаимодействие водородных связей между электроноакцепторной 3- кетогруппой прогестерона и остатками Gln 725 спирали-3 и Arg 766 спирали-5, которые удерживаются в своем положении за счет структурной молекула воды. Было показано, что это взаимодействие присутствует во взаимодействии с различными другими лигандами, например мифепристоном, танапрогетом и асоприснилом, и, таким образом, его можно рассматривать как жизненно важное взаимодействие для функционирования как агонистов, так и антагонистов. Кроме того, было обнаружено , что прогестерон и танапрогет образуют водородную связь с Asn 719 в спирали-3, что дает возможность более высокой селективности и сродства, однако было обнаружено, что асоприснил SPRM не взаимодействует с этим остатком. Даже несмотря на то, что полярный остаток Thr 894 находится в непосредственной близости от карбонильной группы C 20 прогестерона, между этими химическими группами не образуется никакой водородной связи. Важно отметить, что Thr 894 взаимодействует с другими лигандами.
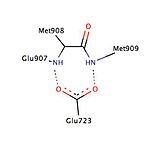
Различные исследования описали наличие гидрофобного кармана, называемого карманом 17α, который состоит из Leu 715 , Leu 718 , Phe 794 , Leu 797 , Met 801 и Tyr 890 и, по-видимому, обеспечивает дополнительное пространство для экспансии лиганда независимо от агонизма или антагонизма. . Карман 17α вместе с Met 756 и Met 759 внутри спирали-5, а также Met 909 демонстрируют удивительную гибкость в аккомодации различных лигандов, что делает рецептор прогестерона очень адаптивным, когда дело доходит до связывания. Исследования, сравнивающие конформационные изменения спирали-12, способствующие агонистическим и антагонистическим эффектам, показали важное взаимодействие водорода с остатком Glu 723 спирали-3. В неактивном состоянии Glu 723 стабилизирует конформацию спирали-12, образуя водородную связь с аминами основной цепи в Met 908 и Met 909 . Когда лиганд проводит агонист эффект, такие как оксит группа asoprisnil , взаимодействующие с агонистом связывающего карманом, то взаимодействие водородной связи между ранее упомянутыми остатками в спирали-12 и спирали-3 усиливает, что приводит к стыковке и набору коактиваторов. Однако, когда антагонист, например мифепристон, взаимодействует с этой системой водородных связей, его диметиламиновая группа сталкивается с Met 909 и дестабилизирует спираль-12, вызывая конформационное изменение, которое способствует привлечению корепрессоров.
Механизм действия
Когда SPRM связываются с рецептором прогестерона, равновесие между двумя конформационными состояниями более сбалансировано и, следовательно, легче нарушается различиями в клеточной среде. В тканях, где концентрация коактиваторов выше, чем корепрессоров, избыток соактиваторов приводит к равновесию в направлении агонистов. И наоборот, в тканях, где концентрация корепрессора выше, равновесие движется в направлении антагониста. Следовательно, SPRM проявляют агонистическую активность в тканях, где преобладают коактиваторы, и антагонистическую активность, где корепрессоры в избытке.
В неактивном состоянии рецептор прогестерона, как и другие рецепторы стероидов, образует комплекс, состоящий из самого себя, белков теплового шока (hsp70, hsp90) и иммунофилинов . При активации из-за связывания гормона с лиганд-связывающим карманом рецепторный комплекс, как было показано, диссоциирует, запуская ядерный импорт и придавая рецептору свойство димеризации (рис. 3). В ядре димер взаимодействует с ответным элементом гормона прогестерона в ДНК, вызывая повышающую или понижающую регуляцию гена. Различные исследования показали, что он влияет на экспрессию до 100 различных генов в зависимости от изомера рецептора. При действии агонизма происходят конформационные изменения, когда альфа-спирали 3, 4 и 12 создают стыковочную поверхность для белков-коактиваторов, которые действуют как факторы связывания между рецептором и общим аппаратом транскрипции. Однако антагонист препятствует правильной упаковке альфа-спирали 12 против спиралей 3 и 4, нарушая способность рецептора взаимодействовать с коактиваторами, что позволяет задействовать корепрессор , такой как SMRT и NCoR . Из-за минимального набора корепрессоров во время связывания с агонистами Liu et al., 2002 постулировали, что соотношение между набором коактиваторов и корепрессоров может быть определяющим фактором того, считается ли соединение агонистом, антагонистом или смешанным агонистом. антагонист. Селективные модуляторы рецепторов прогестерона были описаны как агенты со смешанной агонист-антагонистической активностью, и, таким образом, механизм действия должен быть обусловлен балансом этих функций.
Отношения структура-деятельность
Стероидные SPRM
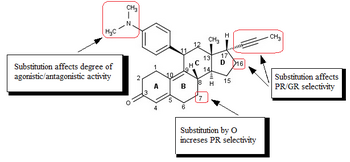
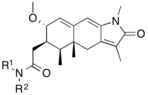
Исследования аналогов мифепристона , направленные в основном на улучшение соотношения антипрогестационной / антиглюкокортикоидной активности, привели к открытию SPRM. Модификации 17-альфа пропинильной группы или около нее (рис. 4) на кольце D играют ключевую роль в связывании с рецептором прогестерона и / или рецептором глюкокортикоидов. Незначительные изменения в области 17-альфа генерируют антипрогестины со сниженной антиглюкокортикоидной активностью, где альфа относится к абсолютному стероидному стереодескриптору. Похоже, что гидрофобные заместители 17-альфа, такие как 17-альфа-этил и 17-альфа (1'-пентинил), обладают более высокой антипрогестационной активностью, чем мифепристон. Было обнаружено, что замещение в положении 17-альфа с участием фенильной группы небольшими электроноакцепторными заместителями, такими как F и CF 3 , в пара- положении также значительно увеличивает селективность по отношению к глюкокортикоидному рецептору, а также эффективность полученных соединений. Такая же замена в орто - или мета - положении приводила к снижению селективности. Объемные заместители, такие как трет- бутил, в этой области снижают активность прогестерона.
Имеющиеся биологические и рентгеновские данные позволяют предположить, что замещение 4- (диметиламино) фенильной группы в положении C11 (рис. 4) определяет степень агонистической и антагонистической активности. Небольшие заместители, такие как метил или винил, вызывают сильные агонистические свойства рецепторов прогестерона, тогда как замещенные фенильные производные проявляют различные степени антагонистической активности. При замещении различными азотными гетероциклами есть указание на то, что наиболее агонистическими являются соединения с явным максимумом отрицательного электрического потенциала в области мета- и пара- атомов арильного кольца, тогда как соединения, у которых отсутствует центр электроотрицательности. в этой области обладают наибольшей антагонистической активностью.
Модификация основной стероидной структуры влияет на способ связывания с рецептором прогестерона. Замещение C7 (рис. 4) атомом кислорода было исследовано, и эти мифепристоноподобные оксастероиды показали повышенную селективность по сравнению с рецептором глюкокортикоидов, но были менее эффективны, чем мифепристон.
Нестероидные СМПР
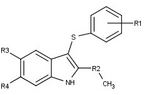
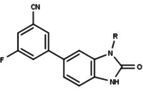
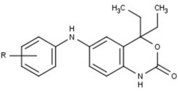
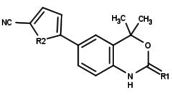
Модуляторы рецепторов прогестерона с уникальными нестероидными структурами в настоящее время находятся на ранних стадиях разработки (рис. 5-12). Сообщалось о множестве новых типов антагонистов рецепторов прогестерона с разной степенью активности, которые демонстрируют замечательное структурное разнообразие, которое можно увидеть в таблице ниже. Различные ведущие соединения также были идентифицированы как новые агонисты рецепторов прогестерона. Их также можно посмотреть в таблице.
| Антагонисты | |||||
|---|---|---|---|---|---|
| Агонисты |
Наркотики
Члены включают:
- Улипристала ацетат («Элла»)
- Азоприснил (J867; статус неизвестен)
- Телапристон (CDB-4124; Proellex, Progenta; в разработке)
SPRM был предложен для множества гинекологических применений, таких как контрацепция и экстренная контрацепция, лечение эндометриоза , лейомиомы матки и в качестве заместительной гормональной терапии у женщин в постменопаузе. Активность SPRM в основном опосредуется рецептором прогестерона, где эндометрий является основной тканью-мишенью. В отличие от обычных антагонистов прогестерона, SPRM исключают возможность прерывания беременности из-за своего смешанного профиля антагонистов / агонистов. Поскольку SPRM имеют низкое сродство к рецептору эстрогена, считается, что они не вызывают потерю костной массы, связанную с постменопаузой. Использование SPRM связано с метаплазией эндометрия , что требует долгосрочной оценки безопасности.
| Сложный | Химическая структура |
|---|---|
| Улипристала ацетат | Рисунок 13 |
| Асоприснил | Диаграмма 14 |
| Телапристон | Рисунок 15. |
Улипристала ацетат
Улипристала ацетат (также известный как CDB-2914) (рис. 13) представляет собой 11-β-арилзамещенный SPRM, который доступен в Европе в качестве средства экстренной контрацепции с 2009 года и был одобрен FDA в 2010 году. Он также продается как средство для лечения матки. лейомиома в Северной Америке и Европе. В качестве экстренной контрацепции улипристала ацетат показал свою эффективность в течение 120 часов после незащищенного полового акта по сравнению с 72-часовой эффективностью текущих средств экстренной контрацепции. В постменопаузальном эндометрии соединение, по-видимому, обладает антагонистическим действием на рецептор прогестерона, что указывает на его потенциальное использование в лечении менопаузы, но это еще не подтверждено.
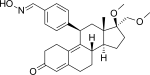
Асоприснил
Азоприснил (J867) представляет собой стероидный 11β-бензальдоксим-замещенный SPRM (фиг. 14). Предполагается, что геометрия его оксимной группы играет важную роль в эффективности in vitro . Он был предложен в качестве лечения лейомиомы и эндометриоза, и это первый SPRM в клинической разработке лечения эндометриоза, достигший продвинутой фазы.
Телапристон
Телапристон (CDB-4124), также известный как Proellex (рис. 15), вошел в фазу II клинических испытаний для лечения миомы матки в 2014 году и запланировал клинические испытания фазы II для облегчения симптомов эндометриоза в начале 2016 года. было предложено иметь химиопрофилактический эффект.
Использует
SPRM разрабатываются для следующих целей:
- И азоприснил, и телапристон находятся на стадии исследования (2005 г.) для лечения лейомиомы матки .
- Компания Proellex завершила ряд клинических испытаний по лечению эндометриоза и миомы матки.
Хотя эти SPRM были эффективны для лечения миомы матки, развитие побочных эффектов, таких как утолщение эндометрия, ограничивало их применение не более чем тремя-четырьмя месяцами.
Будущее
Из-за его антиглюкокортикоидной активности мифепристон исследуется на предмет его терапевтического потенциала при таких показаниях, как синдром Кушинга , болезнь Альцгеймера или психоз . Кроме того, разрабатываются СМПР для различных гинекологических применений, включая безэстрогенную контрацепцию, лейомиому матки и эндометриоз.
Смотрите также
- Фитопрогестоген
- Селективный модулятор рецепторов андрогенов
- Селективный модулятор рецепторов эстрогена
- Селективный агонист рецепторов глюкокортикоидов
- Селективный модулятор рецепторов